Study on the Hypoglycemic Effect and Mechanism of Qidan Fang on Diabetic Mice
-
摘要:目的 研究杞丹方对糖尿病小鼠降血糖作用并探讨相关机制。方法 取SPF级ICR雄性小鼠, 禁食16 h后腹腔注射四氧嘧啶120 mg·kg-1, 5 d后禁食12 h测血糖, 血糖值在10~25 mmol·L-1为糖尿病造模成功。将造模成功的ICR雄性糖尿病小鼠, 分为模型组, 二甲双胍组, 杞丹方低、中、高剂量组(0.34、0.67、1.34 g·kg-1·d-1), 正常ICR雄性小鼠为空白组, 给药30 d。每10 d记录体质量和空腹血糖(FBG)1次, 30 d后进行葡萄糖耐量试验(OGTT); ELISA法检测血清胰岛素水平并摘取胰腺、肝脏组织, 进行HE染色, 观察其病理改变; 采用Western blot和qPCR检测肝脏组织IRS-1、PI3K、AKT和GLUT4的表达水平。结果 与模型组相比, 杞丹方中、高剂量组小鼠FBG水平、糖耐量显著降低(P < 0.01),血清胰岛素水平显著升高(P < 0.01)。杞丹方各剂量组胰腺和肝脏组织结构有明显改善, 胰岛形态得到一定程度恢复, 少见肝脏组织异常与血管充血。杞丹方高剂量组能显著上调肝脏组织中的p-IRS-1/IRS-1、p-PI3K/PI3K、p-AKT/AKT和GLUT4蛋白表达水平(P < 0.01);显著上调肝脏组织中的IRS-1、PI3Kp85α、AKT1和GLUT4 mRNA水平(P < 0.01)。结论 杞丹方对糖尿病小鼠具有降血糖作用, 其作用机制是通过调控IRS-1/PI3K/AKT信号通路来实现的。Abstract:OBJECTIVE To investigate the hypoglycemic effect of Qidan Fang on diabetic mice and explore its relevant mechanism.METHODS The SPF ICR mice were intraperitoneally injected with 120 mg·kg-1 alloxan after fasting for 16 h. The blood glucose was measured after fasting for 12 h after 5 d. The blood glucose of 10~25 mmol·L-1 was defined as the successful establishment of the diabetic mouse model. The male diabetic ICR mice were divided into the model group, metformin group, low-, medium- and high-dose Qidan Fang groups (0.34, 0.67, 1.34 g·kg-1·d-1, respectively), and administrated for 30 d. Additionally, normal male ICR mice were selected as the blank group. Body mass and fasting blood glucose (FBG) were recorded once every 10 d, and a glucose tolerance test (OGTT) was performed after 30 d. Serum insulin level was detected by ELISA, and then pancreas and liver tissues were collected for HE staining to observe their pathological changes. The expression levels of IRS-1, PI3K, AKT and GLUT4 in the liver tissues were determined by Western blot and qPCR.RESULTS Compared with the model group, the level of FBG and glucose tolerance decreased significantly (P < 0.01), and the serum insulin level increased significantly (P < 0.01), in the medium- and high-dose Qidan Fang groups; The tissue structure of the pancreas and liver was significantly improved, islet morphology recovered to a certain extent, and liver tissue abnormalities and vascular congestion were rarer in the low-, medium- and high-dose Qidan Fang groups. High dose of Qidan Fang could significantly up-regulate the protein expression levels of p-IRS-1/IRS-1, p-PI3K/PI3K, p-AKT/AKT and GLUT4 in liver tissues (P < 0.01), while significantly up-regulate the mRNA levels of IRS-1, PI3Kp85α, AKT1 and GLUT4 in liver tissues (P < 0.01).CONCLUSION Qidan Fang has a hypoglycemic effect on diabetic mice, and its mechanism is relative to the regulation of IRS-1/PI3K/AKT signaling pathway.
-
Keywords:
- diabetes /
- Qidan Fang /
- IRS-1 /
- PI3K /
- AKT
-
糖尿病以高血糖为特征, 伴有微血管、大血管并发症如糖尿病视网膜病变、糖尿病肾病、心血管疾病等, 会导致糖尿病患者失明、肾衰竭甚至死亡[1-2]。1型糖尿病约占所有糖尿病患者的5%~10%, 胰岛素抵抗在1型糖尿病的流行病学和代谢研究中已经被证实和量化[3-6]。
中医认为糖尿病属于“消渴病”范畴, 发病机制为气阴两虚, 燥热伤津。糖尿病发病初期以气、血、痰、火、湿、食六郁为主, 病位多在肝脾。临床常用中药有黄芪、丹参、山茱萸、枸杞子等, 入脾、肝经[7]。故中医对糖尿病的论治可从肝入手, 以清热养阴, 活血益气为治法。杞丹方具有滋阴清热、补气活血的功效, 全方由枸杞子、黄芪、桑叶、山茱萸、丹参组成。方中的枸杞子、黄芪、桑叶、山茱萸、丹参药材均具有一定的降血糖作用[8-12]。研究表明IRS-1/PI3K/AKT是调控血糖的主要信号通路, 该通路异常是糖尿病发生的重要原因[13-14]。故本实验以IRS-1/PI3K/AKT信号通路为切入点, 采用四氧嘧啶建立糖尿病小鼠模型, 观察杞丹方降血糖作用, 为其临床疗效提供科学依据。
1. 材料
1.1 动物
SPF级雄性ICR小鼠, 体质量22~24 g, 由浙江维通利华实验动物技术有限公司提供, 许可证号: SCXK(浙)2019-0001。实验动物均用全价颗粒饲料喂养, 由南京江宁区协同中心提供。温度: 19~24 ℃; 湿度: 48%~67%。动物实验通过南京中医药大学伦理委员会审查, 伦理号: 202105A026,实验过程符合动物伦理规范。
1.2 药材
枸杞子Lycium barbarum L. (17200522, 宁夏)、黄芪Astragalus membranaceus (Fisch.) Bge.var. mongholicus (Bge.) Hsiao(22200365, 甘肃)、桑叶Morus alba L. (20201201, 江苏)、山茱萸Cornus officinalis Sieb.et Zucc. (229200206, 河南)、丹参Salvia miltiorrhiza Bge. (20210401, 山东)购自亳州市紫锐药业有限公司, 经南京中医药大学严辉副教授鉴定, 各项检查均符合《中国药典》2020年版要求。
1.3 药品与试剂
四氧嘧啶(批号: 4457780), 上海碧云天生物技术有限公司; 盐酸二甲双胍(批号: ABV0983), 中美上海施贵宝制药有限公司; 柠檬酸-柠檬酸钠缓冲溶液(批号: Y-231566), 上海源叶生物科技有限公司; 多聚甲醛(批号: XS191316), 武汉赛维尔生物科技有限公司; 苏木素-伊红(HE)染色液(批号: G1005), 上海颐昌生物科技有限公司; SYBR Green PCR试剂盒(批号: #K0223)、逆转录试剂盒(批号: #K1622)、Trizol(批号: 1596-026)、BCA蛋白定量试剂盒(批号: PICPI23223), 美国Thermo Fisher Scientific公司; RIPA组织细胞快速裂解液(批号: R0020), 北京索莱宝科技有限公司; ECL试剂盒(批号: WBKLS0100), 美国Millipore公司; p-PI3K抗体(批号:20584-1-AP)、PI3K抗体(批号: 67071-1-Ig)、p-AKT抗体(批号: 66444-1-Ig)、AKT抗体(批号: 60203-2-Ig)、GLUT4抗体(批号: 66846-1-Ig)、IRS-1抗体(批号: 17509-1-AP), 美国Proteintech公司; p-IRS-1抗体(批号:ab109543)、β-actin抗体(批号: ab8226), 英国Abcam公司; 小鼠胰岛素(批号: ml001983), 上海酶联生物科技有限公司; 无水乙醇(批号: 100092680)、氯仿(批号: 10023419)、异丙醇(批号: 80109218), 国药集团化学试剂有限公司。
样品制备: 按黄芪16份、枸杞子8份、桑叶6份、山茱萸10份、丹参3份比例称取药材, 20%乙醇加热提取3次, 合并滤液, 静置4 h后滤过, 滤液浓缩后, 经干燥处理, 制得干浸膏样品(1 g干浸膏粉相当于6 g生药量), 给药前干浸膏样品用超纯水充分溶解, 即配即用。
1.4 仪器
AE240型十万分之一电子分析天平, MS105型万分之一电子分析天平(瑞士METTLER TOLEDO公司); DF-100型粉碎机(温岭市林大机械有限公司); Milli-Q型纯水仪(美国Millipore公司); KQ-250E超声清洗仪(昆山禾创超声仪器有限公司); 拜安康contour TS血糖仪(德国BAYER公司); R540小动物麻醉机(深圳市瑞沃德生命科技有限公司); RM2016病理切片机(上海徕卡仪器有限公司); JB-P5包埋机(武汉俊杰电子有限公司); DS-U3成像系统(日本Nikon公司); Real-time PCR检测仪(美国Thermo Fisher公司); 低温冷冻离心机(上海卢湘仪离心机仪器有限公司); 电动匀浆机(上海弗鲁克科技公司); MK3芬兰雷勃酶标仪(美国Thermo Fisher公司); SynergyHT酶标仪(美国Bio-Tik公司); 凝胶成像系统(上海天能科技有限公司)。
2. 方法
2.1 造模、分组与给药
取SPF级ICR雄性小鼠, 禁食16 h后腹腔注射四氧嘧啶120 mg·kg-1, 5 d后禁食12 h测血糖, 血糖值在10~25 mmol·L-1为糖尿病造模成功。选糖尿病模型动物50只, 分为5组, 即模型组、二甲双胍组、杞丹方低剂量组、杞丹方中剂量组、杞丹方高剂量组, 每组10只。另选正常小鼠10只为空白组。二甲双胍组小鼠按0.25 g·kg-1剂量给予盐酸二甲双胍片溶液灌胃; 杞丹方低、中、高剂量组小鼠分别按0.34、0.67、1.34 g·kg-1剂量给予杞丹方溶液灌胃; 模型组和空白组小鼠灌胃给予同等体积蒸馏水。各组每天给药1次, 连续给药30 d。
2.2 一般体征及空腹血糖(FBG)变化
每组小鼠每10 d记录1次体质量和1次FBG。
2.3 葡萄糖耐量试验(OGTT)
给药30 d后小鼠禁食8 h, 给予葡萄糖溶液(2 g·kg-1) 灌胃, 分别检测0、30、120 min的血糖值, 作图并计算曲线下面积(AUC), 得到口服糖耐量值。
2.4 血清胰岛素水平
将小鼠眼眶取血, 离心, 取上清(血清), 按照ELISA试剂盒说明书,用多功能酶标仪检测吸光度, 计算含量。
2.5 HE染色
取固定的胰腺、肝脏组织, 进行脱水、石蜡包埋、切片、染色、封片等步骤, 完成操作后将切片放置显微镜下拍照, 观察其形态特征。
2.6 Western blot检测肝脏组织关键蛋白的表达
冰上将肝脏组织剪成细小的碎片, 按每20 mg组织加入150~250 μL裂解液的比例加入裂解液, 匀浆器匀浆直至完全裂解。裂解后的样品4 ℃ 12 000 r·min-1离心15 min, 取上清, 进行蛋白质定量, 根据蛋白定量结果取所需蛋白加入适量上样缓冲液, 沸水浴10 min后离心取上清上样。冷却后-20 ℃保存。SDS-PAGE电泳后, 转移到PVDF膜上, 加入BSA(0.5 g·L-1)4 ℃过夜。次日, 用PBST洗膜4次, 每次15 min。分别加入二抗, 室温孵育2 h后, 再用PBST洗膜4次, 每次15 min, ECL显色。以β-actin作为内参, 利用Image J软件分析IRS-1、p-IRS-1、PI3K、p-PI3K、AKT、p-AKT和GLUT4蛋白的灰度值, 进行计算定量。
2.7 qPCR检测关键蛋白mRNA水平
采用Trizol一步法提取小鼠肝脏组织中总RNA, 取2 μg反转录为cDNA。取2 μL反转录产物进行PCR反应。按试剂盒说明建立体积为20 μL的PCR反应体系, 反转录产物2 μL、SYBR Green Mix 10 μL、上下游引物(10 μmol·L-1)各0.5 μL。检测结果采用2-ΔΔCt法进行计算, 实验重复3次。引物序列为表 1所示。
表 1 PCR引物序列Table 1. The sequences of PCR primers基因 引物序列(5'→3') IRS-1 上游ATGCTCCCTTGGCTATGATG下游AAGAGTGTCCCTGACCTTTG PI3Kp85α 上游ATGCCAGAAAGGAGAATG
下游TGTTGGACTCAGCAATACAKT1 上游GGGCACATCAAGATAACG
下游TGGTCCTGGTTGTAGAAGGLUT4 上游CCATCGTCATTGGCATTC
下游TAGTGCGTCAGACACATCβ-actin 上游TGAGAGGGAAATCGTGCGTGAC
下游GAACCGCTCGTTGCCAATAGTG2.8 统计学方法
采用GraphPad Prism 8.03统计软件包, 组间比较采用单因素方差分析, 统计结果以x±s表示, 组间两两比较采用t检验, P < 0.05为差异有统计学意义。
3. 结果
3.1 各组小鼠一般体征观察
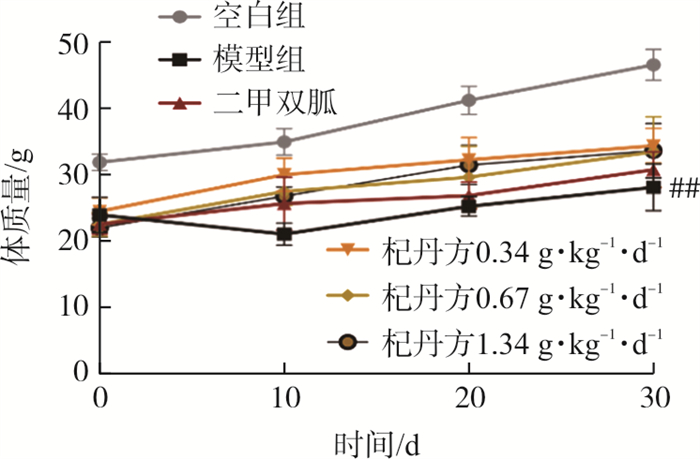
空白组小鼠状态良好, 毛色鲜亮, 毛发顺滑, 活动灵敏迅速。模型组小鼠毛色暗淡, 毛发凌乱, 活动迟缓, 摄食量、摄水量明显增加。杞丹方各剂量组与模型组比较,毛色毛发情况、摄食量、摄水量有所改善。体质量测量结果表明: 与空白组相比,模型组小鼠体质量减轻(P < 0.01), 杞丹方各剂量组与模型组相比体质量无统计学差异, 见图 1。
3.2 各组小鼠FBG水平比较
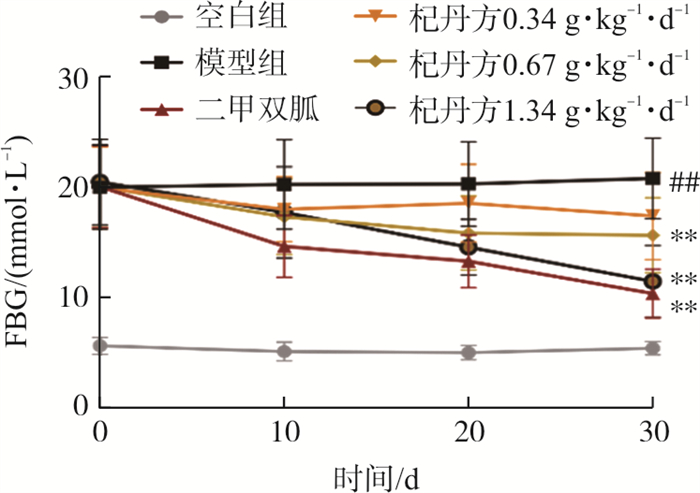
实验结果如图 2所示,模型组小鼠FBG水平升高, 与空白组相比有显著性差异(P < 0.01);给药第10天, 各给药组FBG水平出现降低, 至第30天, 杞丹方中、高剂量组,二甲双胍组与模型组相比FBG水平均显著降低(P < 0.01)。
3.3 各组小鼠OGTT结果比较
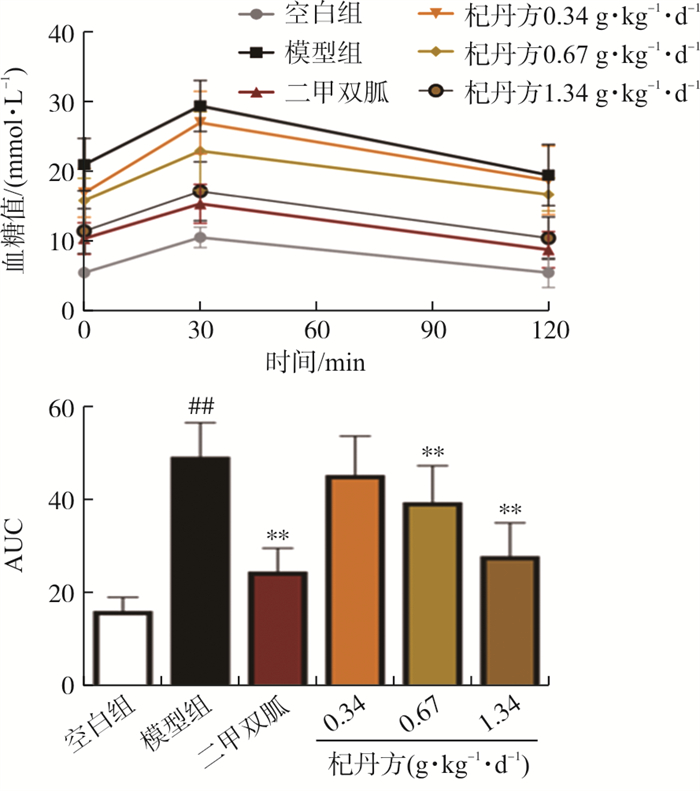
各组血糖值结果显示, 在30 min时, 血糖达到峰值, 空白组在120 min时血糖恢复正常血糖水平, 其余各组血糖均未恢复正常血糖水平。OGTT结果显示,模型组小鼠糖耐量升高, 与空白组小鼠糖耐量相比有显著性差异(P < 0.01);杞丹方中、高剂量组,二甲双胍组与模型组相比均显著降低(P < 0.01)。见图 3。
3.4 各组小鼠血清胰岛素水平比较
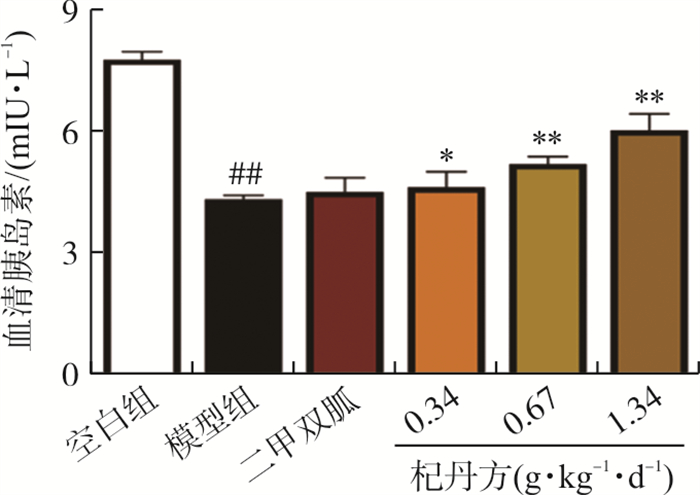
实验结果如图 4所示, 模型组血清胰岛素水平下降, 与空白组相比有显著性差异(P < 0.01);杞丹方各剂量组与模型组相比, 血清胰岛素水平显著升高(P < 0.05,P < 0.01)。
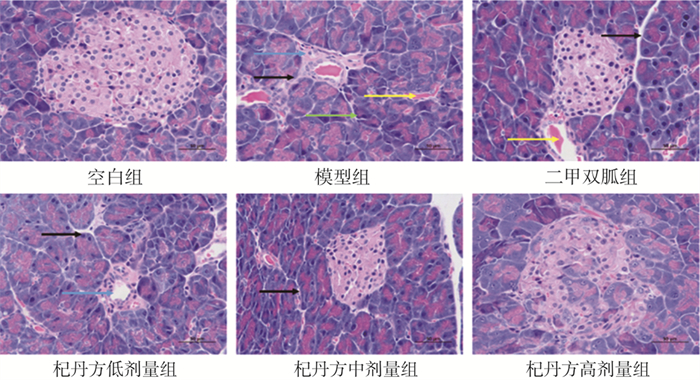
3.5 各组小鼠胰腺组织病理变化
实验结果如图 5显示,空白组胰腺组织正常, 胰腺细胞结构正常, 胞膜清晰。模型组胰腺组织异常, 胰腺组织中可见腺泡细胞排列松散, 脱落、碎裂, 如绿色箭头所示; 胰岛形状不规则, 核固缩,如蓝色箭头所示; 胰岛出现裂隙, 胞质空泡化,如黑色箭头所示; 可见少量毛细血管淤血扩张,如黄色箭头所示。二甲双胍组和杞丹方各剂量组胰腺组织、胰腺细胞排列紧密, 胰岛得到一定程度恢复。
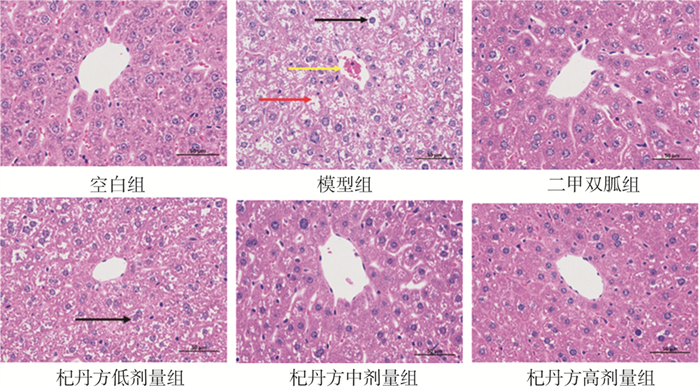
3.6 各组小鼠肝脏组织病理变化
实验结果如图 6所示, 空白组肝脏组织正常, 肝细胞结构正常, 胞膜清晰。模型组肝脏组织异常, 同一肝脏组织中可见多种细胞形态, 肝细胞形态不规则, 细胞界限不清, 如红色箭头所示; 细胞水肿, 部分肝脏细胞核固缩, 结构不完整, 胞核淡染, 如黑色箭头所示; 该区域血管充血, 如黄色箭头所示。二甲双胍组和杞丹方各剂量组肝部组织结构有明显改善, 肝脏细胞偶有核固缩、形态异常, 少见血管充血。
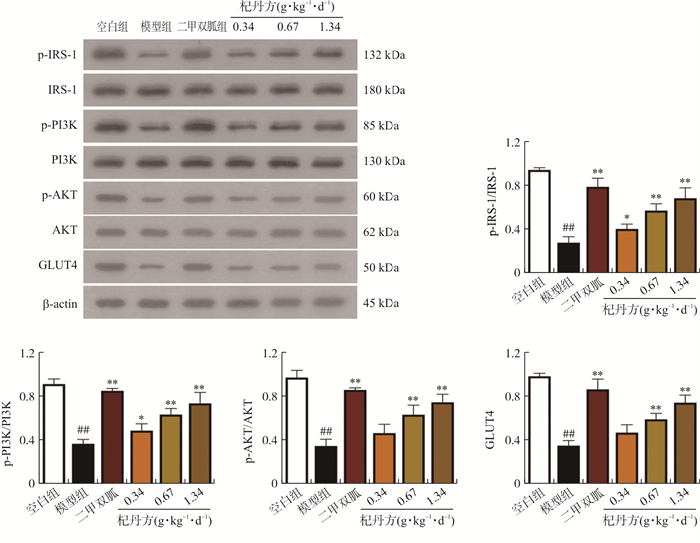
3.7 各组小鼠肝脏组织关键蛋白表达的比较
实验结果如图 7所示, 模型组相关蛋白表达下降,与空白组相比有显著性差异(P < 0.01);杞丹方低剂量组与模型组相比p-IRS-1/IRS-1, p-PI3K/PI3K蛋白表达水平显著升高(P < 0.05);杞丹方中、高剂量组,二甲双胍组与模型组相比p-IRS-1/IRS-1、p-PI3K/PI3K、p-AKT/AKT和GLUT4蛋白表达水平均显著升高(P < 0.01)。
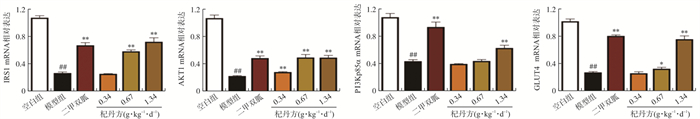
3.8 各组小鼠肝脏组织关键蛋白mRNA表达的比较
实验结果如图 8所示, 模型组关键蛋白mRNA表达水平下降, 与空白组相比有显著性差异(P < 0.01);杞丹方高剂量组、二甲双胍组与模型组相比IRS-1、PI3Kp85α、AKT1和GLUT4 mRNA表达水平均显著升高(P < 0.01)。
4. 讨论
糖尿病是一种多因素、多基因疾病。传统医学认为糖尿病属消渴病, 主要病机为阴虚气盛, 气虚血瘀,故本病应采取滋阴清热、补气活血法治疗。杞丹方由黄芪、枸杞子、桑叶、山茱萸、丹参组成, 滋阴清热、补气活血, 临床用于早期糖尿病的辅助治疗。方中枸杞子、桑叶、山茱萸滋阴清热,黄芪、丹参补气活血。现代药理学研究表明,枸杞子中的甜菜碱可防止饮食引起的肥胖小鼠葡萄糖稳态受损, 减少肝脏脂质积累[15]; 黄芪中的黄芪甲苷可增强胰腺组织的抗氧化能力, 改善胰腺组织损伤, 降低DKA幼鼠的血糖并提高胰岛素水平[16]; 桑叶中主要生物碱1-脱氧野尻霉素具有降糖作用, 可显著降低糖尿病小鼠血糖, 逆转胰岛素抵抗[17]; 山茱萸中环烯醚萜类成分如马钱苷能增加小鼠体质量, 降低1型糖尿病大鼠血糖水平, 提高糖耐量[18];丹参中的丹酚酸B显著降低db/db小鼠的FBG水平, 降低肝脏葡萄糖异生基因表达[19]。因此推测杞丹方效应物质基础可能为生物碱类如甜菜碱、1-脱氧野尻霉素, 皂苷类如黄芪甲苷, 环烯醚萜类如马钱苷, 酚酸类如丹酚酸B。据文献报道[20]四氧嘧啶可破坏小鼠胰岛细胞、损伤肝脏, 造成小鼠胰岛及肝脏受损、胰岛素分泌不足及胰岛素抵抗, 形成糖尿病。故本研究采用腹腔注射四氧嘧啶的方法制备小鼠糖尿病模型, 研究杞丹方降血糖作用。结果表明杞丹方可显著降低小鼠血糖, 升高胰岛素水平, 减轻胰腺组织损伤, 有利于改善糖尿病的病理状态。
1型糖尿病肝脏的代谢与胰岛素供应有关, 肝脏是胰岛素作用的靶器官之一, 在糖脂代谢过程中起重要的作用[21-22]。代谢分析显示, 1型糖尿病患者骨骼肌和肝脏的胰岛素敏感性降低12%~61%, 且多种细胞内信号通路参与该过程, 其中IRS-1是激活PI3K/AKT通路的重要配体, 其表达的降低导致胰岛素信号负调控[23-24]。胰岛素与胰岛素受体结合可诱导胰岛素信号转导引起的葡萄糖转运和储存, 活化IRS进而激活PI3K;活化的PI3K可以促进下游靶蛋白AKT发生磷酸化, 使细胞质膜上的p-AKT释放并转移至细胞质内, 促进GLUT4表达, 维持全身葡萄糖稳态[25-26]。二甲双胍是糖尿病临床常用药, Xu等[27]研究表明二甲双胍可能增强胰岛素受体信号传导, 显著增加AKT蛋白的磷酸化水平, 增加GLUT4转运蛋白在细胞膜的聚集, 上调IRS β表达及下游PI3K/AKT信号转导。本研究发现杞丹方对糖尿病小鼠的肝脏组织具有一定的保护作用, 并能上调肝脏组织的关键蛋白IRS-1、PI3K、AKT和GLUT4及其相关mRNA表达水平。表明杞丹方能改善糖尿病小鼠的疾病状态, 其降血糖机制与调节IRS-1/PI3K/AKT信号通路有关, 这为杞丹方临床应用提供科学依据。
-
表 1 PCR引物序列
Table 1 The sequences of PCR primers
基因 引物序列(5'→3') IRS-1 上游ATGCTCCCTTGGCTATGATG下游AAGAGTGTCCCTGACCTTTG PI3Kp85α 上游ATGCCAGAAAGGAGAATG
下游TGTTGGACTCAGCAATACAKT1 上游GGGCACATCAAGATAACG
下游TGGTCCTGGTTGTAGAAGGLUT4 上游CCATCGTCATTGGCATTC
下游TAGTGCGTCAGACACATCβ-actin 上游TGAGAGGGAAATCGTGCGTGAC
下游GAACCGCTCGTTGCCAATAGTG -
[1] YONG J, JOHNSON JD, ARVAN P, et al. Therapeutic opportunities for pancreatic β-cell ER stress in diabetes mellitus[J]. Nat Rev Endocrinol, 2021, 17(8): 455-467. DOI: 10.1038/s41574-021-00510-4
[2] COLE JB, FLOREZ JC. Genetics of diabetes mellitus and diabetes complications[J]. Nat Rev Nephrol, 2020, 16(7): 377-390. DOI: 10.1038/s41581-020-0278-5
[3] DANEMAN D. Type 1 diabetes[J]. Lancet, 2006, 367(9513): 847-858. DOI: 10.1016/S0140-6736(06)68341-4
[4] DEFRONZO RA, HENDLER R, SIMONSON D. Insulin resistance is a prominent feature of insulin-dependent diabetes[J]. Diabetes, 1982, 31(9): 795-801. DOI: 10.2337/diab.31.9.795
[5] MAO YJ, ZHONG WJ. Changes of insulin resistance status and development of complications in type 1 diabetes mellitus: Analysis of DCCT/EDIC study[J]. Diabetes Res Clin Pract, 2022, 184: 109211. DOI: 10.1016/j.diabres.2022.109211
[6] THORN LM, FORSBLOM C, FAGERUDD J, et al. Metabolic syndrome in type 1 diabetes: Association with diabetic nephropathy and glycemic control (the FinnDiane study)[J]. Diabetes Care, 2005, 28(8): 2019-2024. DOI: 10.2337/diacare.28.8.2019
[7] 吴挺超, 岳仁宋, 何茗苠, 等. 基于数据挖掘探讨中药复方治疗糖尿病前期的用药规律[J]. 中药药理与临床, 2021, 37(3): 190-195. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYYL202103037.htm WU TC, YUE RS, HE MM, et al. Medication rule analysis of traditional Chinese medicine formulas in the treatment of prediabetes based on data mining[J]. Pharmacol Clin Chin Mater Med, 2021, 37(3): 190-195. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYYL202103037.htm
[8] 胡馨予, 卢文倩, 孙晓琪, 等. 宁夏枸杞水提物对四氧嘧啶诱导糖尿病小鼠的降糖作用[J]. 食品与生物技术学报, 2019, 38(3): 91-96. DOI: 10.3969/j.issn.1673-1689.2019.03.013 HU XY, LU WQ, SUN XQ, et al. Studies on the hypoglycemic activity of Lycium barbarum L. water extracts[J]. J Food Sci Biotechnol, 2019, 38(3): 91-96. DOI: 10.3969/j.issn.1673-1689.2019.03.013
[9] 王语聪, 谢智鑫, 张学艳, 等. 黄芪对2型糖尿病大鼠碱性磷酸酶与炎症反应的影响[J]. 食品工业科技, 2021, 42(13): 351-357. https://www.cnki.com.cn/Article/CJFDTOTAL-SPKJ202113049.htm WANG YC, XIE ZX, ZHANG XY, et al. Effect of Astragalus on intestinal alkaline phosphatase and inflammatory response in type 2 diabetic rats[J]. Sci Technol Food Ind, 2021, 42(13): 351-357. https://www.cnki.com.cn/Article/CJFDTOTAL-SPKJ202113049.htm
[10] 许继艳, 胡哲, 高燕, 等. 山茱萸提取物对糖尿病小鼠降血糖作用的研究[J]. 时珍国医国药, 2014, 25(10): 2386-2388. https://www.cnki.com.cn/Article/CJFDTOTAL-SZGY201410031.htm XU JY, HU Z, GAO Y, et al. Hypoglycemic effects of iridoid glycoside in Comus officinali extract on diabetic mice[J]. Lishizhen Med Mater Med Res, 2014, 25(10): 2386-2388. https://www.cnki.com.cn/Article/CJFDTOTAL-SZGY201410031.htm
[11] 王德萍, 鱼晓敏, 安馨, 等. 桑叶多组分协同降血糖作用[J]. 现代预防医学, 2018, 45(16): 2924-2928. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYF201816011.htm WANG DP, YU XM, AN X, et al. Synergistic hypoglycemic effects of mulberry leaves multi-components on diabetic mice[J]. Mod Prev Med, 2018, 45(16): 2924-2928. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYF201816011.htm
[12] 张海伶, 马骁. 白花丹参对糖尿病大鼠胰岛B细胞凋亡的影响[J]. 四川大学学报(自然科学版), 2017, 54(6): 1341-1344. DOI: 10.3969/j.issn.0490-6756.2017.06.034 ZHANG HL, MA X. Inhibitory effects of Salvia miltiorrhiza bge. f. alba water extract on apoptosis of islet B cells in rats[J]. J Sichuan Univ Nat Sci Ed, 2017, 54(6): 1341-1344. DOI: 10.3969/j.issn.0490-6756.2017.06.034
[13] CIGNARELLI A, GENCHI V, PERRINI S, et al. Insulin and insulin receptors in adipose tissue development[J]. Int J Mol Sci, 2019, 20(3): 759. DOI: 10.3390/ijms20030759
[14] YANG JY, ZHANG TT, DONG Z, et al. Dietary supplementation with exogenous sea-cucumber-derived ceramides and glucosylceramides alleviates insulin resistance in high-fructose-diet-fed rats by upregulating the IRS/PI3K/Akt signaling pathway[J]. J Agric Food Chem, 2021, 69(32): 9178-9187. DOI: 10.1021/acs.jafc.0c06831
[15] EJAZ A, MARTINEZ-GUINO L, GOLDFINE AB, et al. Dietary betaine supplementation increases Fgf21 levels to improve glucose homeostasis and reduce hepatic lipid accumulation in mice[J]. Diabetes, 2016, 65(4): 902-912. DOI: 10.2337/db15-1094
[16] DENG LL. Astragaloside Ⅳ as potential antioxidant against diabetic ketoacidosis in juvenile mice through activating JNK/Nrf2 signaling pathway[J]. Arch Med Res, 2020, 51(7): 654-663. DOI: 10.1016/j.arcmed.2020.06.013
[17] HU TG, WEN P, SHEN WZ, et al. Effect of 1-deoxynojirimycin isolated from mulberry leaves on glucose metabolism and gut microbiota in a streptozotocin-induced diabetic mouse model[J]. J Nat Prod, 2019, 82(8): 2189-2200. DOI: 10.1021/acs.jnatprod.9b00205
[18] DZYDZAN O, BILA I, KUCHARSKA AZ, et al. Antidiabetic effects of extracts of red and yellow fruits of cornelian cherries (Cornus mas L. ) on rats with streptozotocin-induced diabetes mellitus[J]. Food Funct, 2019, 10(10): 6459-6472. DOI: 10.1039/C9FO00515C
[19] HUANG MQ, ZHOU CJ, ZHANG YP, et al. Salvianolic acid B ameliorates hyperglycemia and dyslipidemia in db/db mice through the AMPK pathway[J]. Cell Physiol Biochem, 2016, 40(5): 933-943. DOI: 10.1159/000453151
[20] 黄凤玲, 邢珂慧, 谢惠, 等. 红枣色素对四氧嘧啶糖尿病小鼠的降血糖作用[J]. 食品科技, 2020, 45(7): 293-297. https://www.cnki.com.cn/Article/CJFDTOTAL-SSPJ202007051.htm HUANG FL, XING KH, XIE H, et al. Hypoglycemic effect of jujube pigment on alloxan-induced diabetic mice[J]. Food Sci Technol, 2020, 45(7): 293-297. https://www.cnki.com.cn/Article/CJFDTOTAL-SSPJ202007051.htm
[21] KUPRIYANOVA Y, ZAHARIA OP, BOBROV P, et al. Early changes in hepatic energy metabolism and lipid content in recent-onset type 1 and 2 diabetes mellitus[J]. J Hepatol, 2021, 74(5): 1028-1037. DOI: 10.1016/j.jhep.2020.11.030
[22] KAUL K, APOSTOLOPOULOU M, RODEN M. Insulin resistance in type 1 diabetes mellitus[J]. Metabolism, 2015, 64(12): 1629-1639. DOI: 10.1016/j.metabol.2015.09.002
[23] BHATTAMISRA SK, KOH HM, LIM SY, et al. Molecular and biochemical pathways of catalpol in alleviating diabetes mellitus and its complications[J]. Biomolecules, 2021, 11(2): 323. DOI: 10.3390/biom11020323
[24] ATKINSON MA, EISENBARTH GS, MICHELS AW. Type 1 diabetes[J]. Lancet, 2014, 383(9911): 69-82. DOI: 10.1016/S0140-6736(13)60591-7
[25] YU WZ, FAN LD, WANG MF, et al. Inside front cover: Pterostilbene improves insulin resistance caused by advanced glycation end products (AGEs) in hepatocytes and mice[J]. Mol Nutr Food Res, 2021, 65(15): 2170037. DOI: 10.1002/mnfr.202170037
[26] JAMES DE, STÖCKLI J, BIRNBAUM MJ. The aetiology and molecular landscape of insulin resistance[J]. Nat Rev Mol Cell Biol, 2021, 22(11): 751-771. DOI: 10.1038/s41580-021-00390-6
[27] XU H, ZHOU Y, LIU YX, et al. Metformin improves hepatic IRS2/PI3K/Akt signaling in insulin-resistant rats of NASH and cirrhosis[J]. J Endocrinol, 2016, 229(2): 133-144. DOI: 10.1530/JOE-15-0409
-
期刊类型引用(3)
1. 王娇娇,康惠丽,冯石卜,姜祎,宋小妹,邓翀. 南五味子多糖对高糖损伤INS-1细胞及糖尿病小鼠的改善作用. 中南药学. 2024(11): 2858-2863 .  百度学术
百度学术
2. 崔胜文,罗双群. 霍山石斛多糖的闪式提取工艺优化及降血糖作用研究. 食品安全质量检测学报. 2023(04): 305-313 .  百度学术
百度学术
3. 余秀琪,植春婷,李洁怡,申利群,邢舟,谢凤凤,张淼,韦凤超,韦都东,朱华,许立拔. 单次大剂量观察壮瑶药提取物对STZ所致高血糖小鼠的降血糖作用研究. 壮瑶药研究. 2023(03): 218-230+523-524 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: