Antipyretic Activity of Sulfhydryl Active Fractions Extracted From Bubali Cornu
-
摘要:目的 制备水牛角含巯基类成分(-SH active fractions, SHF), 评价其解热效应。方法 通过十二烷基硫酸钠-二硫苏糖醇(SDS-DTT)联合提取法制备水牛角SHF, 并采用Ellman法测定游离巯基(-SH)浓度; 基于nano LC-MS/MS分析表征水牛角SHF物质组成。采用脂多糖(LPS)建立大鼠发热模型评价水牛角SHF解热活性, 采用酶联免疫吸附法(ELISA)试剂盒测定血浆中前列腺素E2(PGE2)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)的水平, 测定下丘脑环磷酸腺苷(cAMP)、PGE2、TNF-α的水平; 采用非靶向代谢组学的方法, 探究水牛角SHF对发热大鼠血浆代谢物干预情况。结果 SDS-DTT联合提取法可有效制备水牛角SHF, 其中主要成分为含丰富半胱氨酸残基(Cysteine, Cys)的Ⅰ型、Ⅱ型角蛋白、角蛋白相关蛋白等, SHF的-SH占蛋白质比例较水牛角水提液提高了约20倍。发热大鼠给予水牛角SHF 0.5 h后大鼠体温显著下降(P < 0.01), 且解热效应持续4.5 h; 同时显著降低血浆及下丘脑PGE2、IL-1β、TNF-α、cAMP等水平。从空白组与模型组血浆样本中共鉴定出137个潜在差异代谢物, 水牛角SHF可回调其中31个代谢物, 包括溶血磷脂酸、磷脂酰肌醇、磷脂酸、甘油三酯、磷脂酰胆碱等, 主要涉及甘油磷脂代谢通路。结论 水牛角SHF解热效应确切, 给药剂量为水提液的1/10即可显示与其相当的解热效应, 为水牛角清热功效物质基础研究提供了方向和依据。Abstract:OBJECTIVE To extract the -SH active fractions (SHF) from Bubali Cornu (water buffalo horn) and evaluate its antipyretic activity.METHODS SHF was extracted from Bubali Cornu by SDS-DTT, and the content of native thiols (-SH) was determined by Ellman reagent method. SHF was identified based on nano LC-MS/MS technology. Evaluation of antipyretic activity of SHF was based on LPS-induced fever rat model. The levels of PGE2, IL-1β, and TNF-α in plasma as well as the levels of cAMP, PGE2, and TNF-α in the hypothalamus were measured by ELISA kits. An untargeted metabolomics approach was used to further investigate the intervention of SHF on plasma metabolites in febrile rats.RESULTS SDS-DTT could effectively extract SHF from Bubali Cornu, in which the main components were type Ⅰ, type Ⅱ keratins and keratin-associated proteins, which were rich in Cys, and the ratio of -SH to protein in SHF was increased about 20 times more than that of traditional decoction. SHF could significantly decrease (P < 0.01) the body temperature which lasted for 4.5 hours. SHF could also significantly decrease the levels of PGE2, IL-1β, TNF-α and cAMP in plasma and hypothalamic. A total of 137 potentially differential metabolites were identified from plasma samples of the control and model groups, of which 31 metabolites could be dialed back after SHF administration, including lysophosphatidic acid, phosphatidylinositol, phosphatidic acid, triglycerides, phosphatidylcholine and so on, which were mainly involved in the glycerophospholipid metabolic pathway.CONCLUSION SHF has precise antipyretic effect, and the dosage of 1/10 of the aqueous extract can show its comparable antipyretic effect, which provides the direction and basis for the basic research on the antipyretic efficacy of Bubali Cornu.
-
Keywords:
- Bubali Cornu /
- -SH active fractions /
- antipyretic /
- anti-inflammatory /
- non-targeted metabolome
-
水牛角(Bubali Cornu)是牛科动物水牛的角, 始载于《名医别录》: “疗时气寒热头痛”[1], 为我国传统的动物类中药, 具有清热凉血, 解毒定惊的功效, 常用于温病高热、神昏谵语、发斑发疹、吐血衄血、惊风、癫狂等疾病的治疗[1-2]。课题组前期研究表明水牛角含巯基类成分(-SH active fraction, SHF)为重要的功效物质, 通过纳米材料、亲和层析等方法制备的水牛角含-SH肽类成分能够显著提高氧化损伤小鼠微脑血管内皮细胞的存活率, 并减少炎症损伤小鼠单核巨噬细胞炎症因子IL-6、IL-1β、TNF-α的分泌, 表现出显著的抗炎、抗氧化作用[1]。
现代研究表明, 含-SH或二硫键(-S-S-)类成分具有解热、抗炎、抗氧化等效应, 如N-乙酰半胱氨酸(NAC)、谷胱甘肽(GSH)、α-硫辛酸等, 与-SH、-S-S-类成分参与机体炎症、氧化应激通路等有关, NAC一方面通过抑制MAPK/NF-κB信号通路发挥抗炎作用, 另一方面通过激活Nrf2通路减轻氧化应激[3-4]; GSH能够通过激活Nrf2/HO-1信号通路从而降低过氧化氢诱导的细胞毒性和活性氧的产生[5]; α-硫辛酸通过抑制NF-κB信号通路, 下调IL-6、IL-1β及TNF-α的表达, 减轻LPS诱导的炎症模型[6]。
角蛋白含有丰富的-SH、-S-S-类成分, 并具有解热、镇痛、抗惊厥等作用[7], 课题组前期采用纳米材料富集、亲和树脂层析等方法制备了水牛角SHF, 并从细胞层面评价其抗炎、抗氧化作用[1, 3]。然而, 这些方法过程繁琐, 且富集量为μg或mg级别, 仅可实现细胞层面评价其效应, 无法确保动物实验及后续深入研究的开展。
为此, 本文采用十二烷基硫酸钠-二硫苏糖醇(SDS-DTT)联合提取法制备了g级别的水牛角SHF, 并对其物质基础及-SH水平进行分析表征。采用LPS致大鼠发热模型[8], 评价水牛角SHF的解热效应, 同时测定了血浆和下丘脑中关键炎症因子的水平, 并采用非靶向代谢组学研究水牛角SHF对发热大鼠血浆代谢物的干预情况, 以期深入阐明水牛角发挥解热效应的物质基础, 为效应机制评价提供科学依据。
1. 材料
1.1 实验动物
SPF级SD雄性大鼠, 体质量180~220 g。购自上海斯莱克实验动物有限责任公司, 实验动物生产许可证号: SCXK(沪)2022-0004, 饲养于南京中医药大学实验动物中心, 室温保持在21~25 ℃, 相对湿度为45%~50%, 自由进食和饮水。动物实验经南京中医药大学动物实验伦理委员会批准(伦理批件号: 202304A047)。
1.2 药材与试剂
水牛角购自江苏淮安, 经南京中医药大学刘圣金教授鉴定为牛科动物水牛Bubalus bubalis Linnaeus的角, 符合2020年版《中华人民共和国药典》项下标准。BCA蛋白浓度测定试剂盒[翌圣生物科技(上海)股份有限公司, 批号: B0220871];5, 5′-二硫代双-2-硝基苯甲酸(DTNB)、二硫苏糖醇(DTT)、1.5 mol·L-1 Tris-HCl缓冲液pH 8.8、十二烷基硫酸钠(SDS)(南京翼飞雪生物科技有限公司, 批号: 809Q051、125B0424、TU1124、YS0005-500);碘乙酰胺(IAA)(合肥博美生物科技有限责任公司, 批号: PD110503);乙二胺四乙酸(EDTA)、人工小肠液(上海源叶生物科技有限公司, 批号: D09HS203547、L17M11G113388);氯化钠(NaCl)、戊巴比妥钠、羧甲基纤维素钠(CMC-Na)(国药集团化学试剂有限公司, 批号: 20220117、F20020405、20120110);半胱氨酸(上海阿拉丁试剂有限公司, 批号: G2013204);阿司匹林肠溶片(德国Bayer公司, 批号: BJ71772);LPS(Sigma公司, 批号: 0000189847);氯化钠注射液(辰欣药业股份有限公司, 批号: E23050223);PGE2试剂盒、IL-1β试剂盒、TNF-α试剂盒、cAMP试剂盒(上海酶联生物科技有限公司, 批号: 20230810A-25036B、20230810A-16514B、20230810A-10064B、20230810A-36512B); 丙酮、乙醇(分析纯, 国药集团化学试剂有限公司, 批号: 20180113、20221205);三氟乙酸(TFA)(色谱纯, 上海麦克林生化科技股份有限公司); 乙腈(色谱纯, 美国天地试剂公司, 批号: 23095227);甲醇(质谱纯, Sigma, 批号: I117007144);甲酸(质谱纯, Thermo Fisher Scientific, 批号: WA3144081)。
1.3 仪器
Waters Xevo G2-XS QTof系统(英国Waters公司); MassLynx质谱工作站(英国Waters公司); 戴安U3000 Nano RSLC纳升液相系统(美国DIONEX公司); Thermo Q Exactive Plus Orbitrap质谱仪(美国Thermo Fisher公司); Multiskan GO型全波长酶标仪(Thermo Fisher Scientific); Tiss-24组织研磨仪(上海净信实业发展有限公司); 3-16PK高速冷冻离心机(美国Sigma公司); 7810040型真空浓缩蒸发仪(美国Labconco公司); Freezone 4.5 plus冷冻干燥机(美国Labconco公司); YT308医用电子体温计(江苏鱼跃公司); BT 125 D型电子分析天平(德国Sartorious公司); FA 2004型电子分析天平(上海上平仪器设备有限公司); MO-AOR型培养箱(美国Major Science公司)。
2. 方法
2.1 溶液的制备
2.1.1 水牛角水提液的制备
称取约50 g过45目筛的水牛角粉末, 加入500 mL水, 回流提取8 h, 滤过, 得滤液; 滤渣加入400 mL水回流提取8 h, 滤过, 合并2次滤液, 将其适当浓缩后5 000 r·min-1离心15 min, 取上清, 得水牛角水提液。
2.1.2 水牛角SHF的制备
按质量体积比1 g∶10 mL加入SDS-DTT缓冲液(含0.1mol·L-1 DTT的4%SDS Tris-HCl buffer), 60 ℃水浴搅拌过夜, 5 000 r·min-1离心15 min, 取上清, 再用终浓度为80%的乙醇4 ℃沉淀过夜, 5 000 r·min-1离心15 min, 弃上清, 沉淀用80%乙醇洗涤2次, 敞口放置1 h, 得到干燥的水牛角SHF, -80 ℃下冷冻保存。动物实验临用前用0.5%CMC-Na溶液配成一定浓度的混悬液。
2.2 水牛角样品中蛋白和游离-SH的含量测定
将干燥后的水牛角SHF研磨粉碎, 按质量体积比1 g∶5 mL加入人工小肠液, 37 ℃摇床翻转12 h后, 3 000 r·min-1离心10 min, 取上清, 得酶解后的水牛角SHF, 用BCA蛋白浓度测定试剂盒和Ellman比色法分别测定水牛角样品的蛋白浓度和游离-SH含量[3]。
2.3 基于nano LC-MS/MS技术鉴定水牛角SHF
2.3.1 样品前处理
按照蛋白和胰酶质量比为100∶1的比例向水牛角样品中加入0.1 μg·μL-1的胰酶, 37 ℃水浴12 h, 加入10%TFA终止酶解后加入0.1 mol·L-1 DTT, 放置30 min, 加入0.2 mol·L-1 IAA, 避光放置30 min, 采用Waters Sep-Pak C18固相萃取小柱脱盐后浓缩挥干, 加入0.1%甲酸溶解为1.0 μg·μL-1的样品, 待进质谱分析。
2.3.2 色谱与质谱条件
色谱条件: 色谱柱为Reprosil C18AQ柱(150 mm×75 μm, 5 μm); 进样量为2 μL, 流速为400 nL·min-1; 流动相A为乙腈-甲酸-水(2 ∶ 0.2 ∶ 98), 流动相B为乙腈-甲酸-水(80 ∶ 0.2 ∶ 20), 2%~30%B线性梯度洗脱60 min。
质谱条件: 喷雾电压为2.5 kV; 离子传输毛细管温度200 ℃; 质谱一级全扫描范围m/z 300~2000;分离宽度3。串联质谱分析获得总离子色谱图(TIC), 通过碰撞诱导解离(CID), 产生一系列二级串联质谱图。
采用PEAKS 8.5软件进行搜库分析, 选择牛科蛋白质数据库(Bovidae, 2023年1月下载于http://www. uniprot.org); 检索参数: 前体离子误差20 ppm, 子离子误差0.2 Da; 酶切方式: 胰蛋白酶酶切(Trypsin); 翻译后修饰(PTM): 固定PTM为半胱氨酸的氨甲酰甲基化(+57.02), 可变PTM为甲硫氨酸的氧化(+15.99), 脯氨酸的羟基化(+15.99), 天冬氨酸和谷氨酰胺的脱酰胺(+0.98), N端的乙酰化(+42.01);允许两个位点误切, 假阳性率(FDR)≤1%;其他为默认参数, 在上述检索条件下所得的分值有显著性意义(P < 0.05)被认为有效的鉴定结果。
2.4 实验动物造模、分组与给药
实验动物适应性饲养3 d, 实验前3 d每日早晚各1次对大鼠进行适应性测体温操作, 实验前12 h禁食不禁水。实验当日致热前每隔30 min测1次体温, 共2次, 取平均值作为基础体温, 选取体温范围在36.5~38.3 ℃, 且体温波动不高于0.5 ℃的大鼠用于实验。
取10只体温合格大鼠腹腔注射(10 mL·kg-1)生理盐水, 作为空白组, 其余大鼠等体积腹腔注射由生理盐水现配的LPS溶液(100 μg·kg-1)建立发热模型。造模5.5 h后选择发热幅度>1 ℃的大鼠, 随机分为模型组、阿司匹林组、水牛角SHF低剂量组、水牛角SHF中剂量组、水牛角SHF高剂量组、水牛角水提液组, 分组后立即灌胃给药(10 mL·kg-1)。水牛角SHF低、中、高剂量组分别按合生药量0.312 5、0.625、1.25 g·kg-1的剂量给予用0.5%CMC-Na溶液配制的水牛角SHF混悬液(按人每日临床剂量合生药量0.05、0.1、0.2 g·kg-1折算); 阿司匹林组按100 mg·kg-1给予阿司匹林肠溶片混悬液(按人每日临床剂量0.016 g·kg-1折算); 水牛角水提液组按合生药量3.125 g·kg-1给予水牛角水提液(按人每日临床剂量0.5 g·kg-1折算); 空白组和模型组同时灌胃等体积0.5% CMC-Na溶液。给药后0.5、1、1.5、2、2.5、3.5、4.5 h测量体温, 计算各组大鼠在各测温点的体温增减值(ΔT, 实测体温值-基础体温值), 分析解热效果。
2.5 样本采集
按照“2.4“项下方法另取一批大鼠分组, 各组大鼠灌胃1 h后, 腹腔注射3%戊巴比妥钠溶液(mg·kg-1)麻醉, 经腹主动脉取血, 采用肝素钠采血管进行血液收集, 4 ℃, 3 000 r·min-1, 离心10 min, 取上清, 得血浆, -80 ℃下冷冻保存。随后于冰上迅速取出全脑, 分离下丘脑组织至液氮速冻, 转移至-80 ℃冰箱保存待测。
2.6 血浆及下丘脑炎症介质的测定
按照ELISA试剂盒说明书测定采集的大鼠血浆中PGE2、IL-1β、TNF-α的含量, 测定下丘脑组织中cAMP、PGE2、TNF-α的含量。
2.7 血浆非靶向代谢组学分析
样品处理: 将“2.5”项下冻存的血浆样本置冰上解冻, 每100 μL血浆加入300 μL冷乙腈沉淀蛋白, 涡旋混匀1 min, 于4 ℃静置30 min后, 4 ℃, 13 000 r·min-1离心15 min, 取上清注入Waters Xevo G2-XS QTof分析。
LC-MS条件: 色谱柱为Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm, 1.8 μm); 正离子模式下流动相为0.1%甲酸水(A)-含0.1%甲酸乙腈(B), 负离子模式下流动相为5 mmol·L-1甲酸铵水(A)-乙腈(B); 梯度洗脱条件: 0~2 min, 5%B; 2~13 min, 5%~95%B; 13~16 min, 95%B; 16~16.5 min, 95%~5%B; 16.5~18 min, 5%B; 柱温40 ℃, 进样量2 μL, 流速0.35 mL·min-1。采用ESI离子源正、负离子模式(ESI+/ESl-), 质量扫描范围m/z 100~1 000;毛细管电压、锥孔电压分别为3.0 kV和30 V; 萃取电压: 2.0 V; 离子源温度120 ℃, 脱溶剂气温度为350 ℃; 锥孔气流量: 50 L·h-1; 碰撞能量: 20~50 eV, 准确质量测定采用亮氨酸-脑啡肽(ESI+: 556.277 1 m/z, ESI-: 554.261 5 m/z)溶液为锁定质量溶液[9]。
数据处理和多元分析: 采用Progenesis QI(V2.4)进行峰对比、拾取、噪声去除、重叠峰解析、标准化、归一化等处理, 分别输出正、负离子模式下由保留时间、质荷比值(m/z)和每个峰值区域的归一化峰面积的数据列表, 导入SIMCA P 14.1进行无监督主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA)。通过OPLS-DA中R2Y(Y的累积模型变化)和Q2(累积的预测变化)2个关键参数评价模型的可靠性, 当参数越接近1.0时, 则模型预测可靠性越高, 通过200次置换检验验证模型是否过拟合[10]。选取VIP>1作为潜在差异代谢物, 采用SPSS 26.0软件对数据进行统计分析, 利用t检验与非参数检验等分析方法检验2组间生物标志物的相对峰面积是否具有显著性差异, 以P < 0.05具有统计学意义筛选得到差异代谢物。使用HMDB(https://hmdb.ca/)数据库及MetaboAnalyst(https://www.metaboanalyst.ca/)进行生物标志物鉴定和代谢通路分析[11]。
2.8 统计分析
采用GraphPad 6.0软件进行数据分析, 实验结果用x±s表示, 体温增减值数据采用两因素重复测量方差分析, 其余组间比较采用单因素方差分析, P < 0.05为差异有统计学意义。
3. 结果
3.1 水牛角水提液及SHF中蛋白和游离-SH的含量
水牛角水提液及SHF中蛋白和游离-SH的含量测定结果如表 1所示, 水牛角水提液中游离-SH浓度与蛋白浓度的比值为0.025 mmol·g-1, 水牛角SHF中游离-SH浓度与蛋白浓度的比值为0.491 mmol·g-1, 约为水牛角水提液的20倍, 表明SDS-DTT联合提取法制备的水牛角SHF的-SH水平显著提高, 与前期研究采用Thiopropyl Sepharose 6B制备的活性部位-SH水平相当[1]。
表 1 水牛角水提液和SHF中蛋白和游离-SH含量(x±s, n=3)Table 1. Protein and free -SH levels in extract of Bubali Cornu(x±s, n=3)样品 游离巯基浓度/(mmol·L-1) 蛋白浓度/(g·L-1) 游离-SH浓度/蛋白浓度/(mmol·g-1) 水牛角水提液 1.618±0.011 64.505±2.749 0.025±0.001 水牛角SHF 42.188±0.530 86.029±2.417 0.491±0.019 3.2 基于nano LC-MS/MS技术表征水牛角SHF
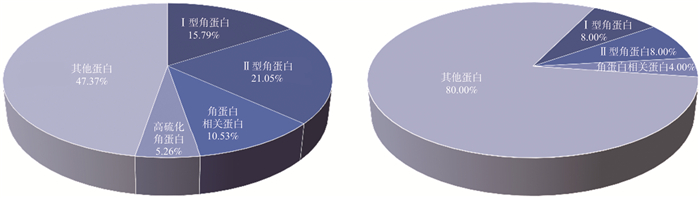
基于nano LC-MS/MS技术从水牛角水提液中共鉴定到100个蛋白质(唯一肽段数≥2), 其中角蛋白和角蛋白相关蛋白占总蛋白数量的20%, 分别为8个Ⅰ型角蛋白、8个Ⅱ型角蛋白和4个角蛋白相关蛋白; 从水牛角SHF中共鉴定到19个蛋白质(唯一肽段数≥2), 其中角蛋白、角蛋白相关蛋白及高硫化角蛋白占总蛋白数量的52.63%, 分别是3个Ⅰ型角蛋白、4个Ⅱ型角蛋白、2个角蛋白相关蛋白和1个高硫化角蛋白。肽类成分分析结果表明, 水牛角水提液共鉴定到1 822条肽段, 其中含-SH肽段为1条, 来源于Ⅱ型角蛋白; 水牛角SHF中共鉴定到211条肽段, 其中含-SH肽段为62条, 有21条来源于Ⅰ型角蛋白, 30条来源于Ⅱ型角蛋白, 3条来源于角蛋白相关蛋白, 4条来源于高硫化角蛋白, 1条来源于桥粒糖蛋白。结果如图 1、表 2所示, 水牛角SHF中角蛋白占总蛋白数的比例大于水牛角水提液, 且含-SH肽段数明显多于水牛角水提液, 亦表明通过SDS-DTT联合提取法可有效获得水牛角含-SH类物质。
表 2 水牛角SHF的蛋白信息Table 2. Protein information for SHF in Bubali Cornu序号 蛋白名称 覆盖率/% 唯一肽段数量 总肽段数量 含-SH肽段数量 1 Keratin-associated protein 3-3 39 2 5 3 2 Keratin-associated protein 3-1 36 2 12 1 3 Keratin, type Ⅰ microfibrillar 48 kDa, component 8C-1 25 8 28 20 4 Keratin, type Ⅱ cuticular Hb1 23 5 18 5 5 Keratin, type Ⅱ cuticular Hb3 20 10 22 15 6 Keratin, high-sulfur matrix protein, ⅢA3 20 4 4 4 7 Keratin, type Ⅰ microfibrillar, 47.6 kDa 19 3 22 13 8 Keratin, type Ⅱ microfibrillar, component 5 18 6 13 4 9 Collagen alpha-1(Ⅰ) chain 17 22 26 - 10 Keratin, type Ⅰ cuticular Ha5 15 4 20 12 11 Ubiquitin-ribosomal protein eL40 fusion protein 15 4 4 - 12 Chymotrypsin-like elastase family member 2A 14 6 6 - 13 Keratin, type Ⅱ cytoskeletal 5 9 19 15 12 14 Collagen alpha-1(Ⅲ) chain 9 15 19 - 15 Collagen alpha-2(Ⅰ) chain 8 9 9 - 16 Heat shock protein beta-1 8 2 2 - 17 Desmocollin-1 4 3 2 1 18 Peroxiredoxin-6 4 2 4 - 19 Desmoglein-1 3 4 4 - 3.3 水牛角SHF对LPS致发热大鼠体温的影响
结果如表 3所示, 与空白组相比, 模型组与给药组大鼠造模5.5 h后, 平均体温升高1 ℃以上, 表明造模成功; 与模型组相比, 水牛角SHF中剂量与高剂量组在给药0.5 h后, 体温下降明显(P < 0.05), 水牛角SHF低剂量组在给药1 h后体温显著下降(P < 0.001), 且与水牛角水提液组降温效果相当, 表明水牛角SHF具有良好的解热作用。
表 3 各组大鼠体温变化(x±s, ℃, n=10)Table 3. Changes in body temperature of rats in each group(x±s, ℃, n=10)分组 剂量/(g·kg-1) 基础体温 造模后5.5 h 给药0.5 h 给药1 h 给药1.5 h 空白组 37.36±0.20 36.97±0.20 36.80±0.15 36.82±0.25 36.84±0.15 模型组 37.73±0.30 39.17±0.23### 39.17±0.37### 39.16±0.37### 39.08±0.17### 阿司匹林组 0.10 37.73±0.27 39.05±0.23### 38.53±0.16** 37.78±0.30*** 37.88±0.31*** 水牛角SHF低剂量组 0.312 5 37.72±0.27 39.05±0.31### 38.78±0.19 38.43±0.44*** 38.37±0.51*** 水牛角SHF中剂量组 0.625 37.91±0.13 39.11±0.17### 38.78±0.59* 38.68±0.57** 38.63±0.51** 水牛角SHF高剂量组 1.25 37.85±0.30 39.12±0.25### 38.67±0.36** 38.61±0.35** 38.39±0.41*** 水牛角水提液组 3.125 37.67±0.27 38.90±0.25### 38.71±0.39* 38.61±0.51** 38.32±0.44*** 分组 剂量/(g·kg-1) 给药2 h 给药2.5 h 给药3.5 h 给药4.5 h 空白组 36.87±0.16 36.93±0.18 36.84±0.20 36.99±0.25 模型组 38.85±0.21### 38.71±0.28### 38.61±0.23### 38.47±0.21### 阿司匹林组 0.10 37.83±0.24*** 37.81±0.25*** 37.90±0.27*** 37.75±0.29*** 水牛角SHF低剂量组 0.312 5 38.16±0.49*** 38.14±0.43** 38.13±0.42* 37.94±0.44* 水牛角SHF中剂量组 0.625 38.36±0.47** 38.30±0.30** 38.24±0.37* 37.99±0.31** 水牛角SHF高剂量组 1.25 38.20±0.30*** 38.11±0.31** 37.94±0.28*** 37.87±0.29** 水牛角水提液组 3.125 38.20±0.40*** 38.14±0.51** 38.04±0.31** 37.93±0.27** 注:与空白组相比, ###P < 0.001;与模型组相比, *P < 0.05, * *P < 0.01, * * *P < 0.001。 3.4 水牛角SHF对发热大鼠血浆及下丘脑组织炎症因子水平的影响
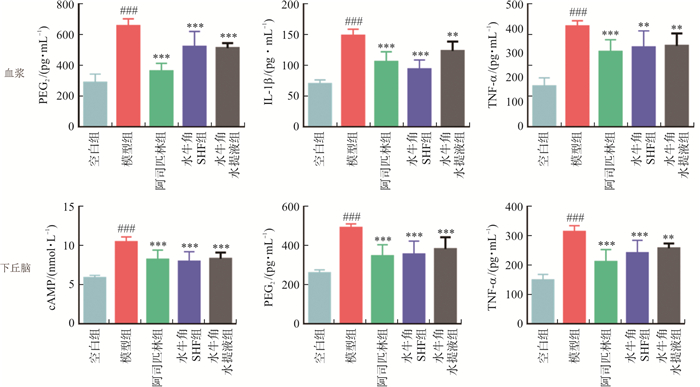
血浆及下丘脑组织中炎症因子的水平如图 2所示。结果表明, 与空白组相比, 模型组血浆中PGE2、IL-1β、TNF-α的水平及下丘脑组织中cAMP、PGE2、TNF-α的水平均显著升高(P < 0.001);与模型组相比, 水牛角SHF能显著降低血浆中PGE2、IL-1β、TNF-α的水平(P < 0.05), 显著降低下丘脑cAMP、PGE2、TNF-α的水平(P < 0.01), 表明水牛角SHF发挥解热作用的机制可能与调节大鼠IL-1β、TNF-α、cAMP、PGE2等细胞因子有关。
3.5 血浆代谢组学分析
3.5.1 UPLC-Q-TOF-MS数据的多元统计分析
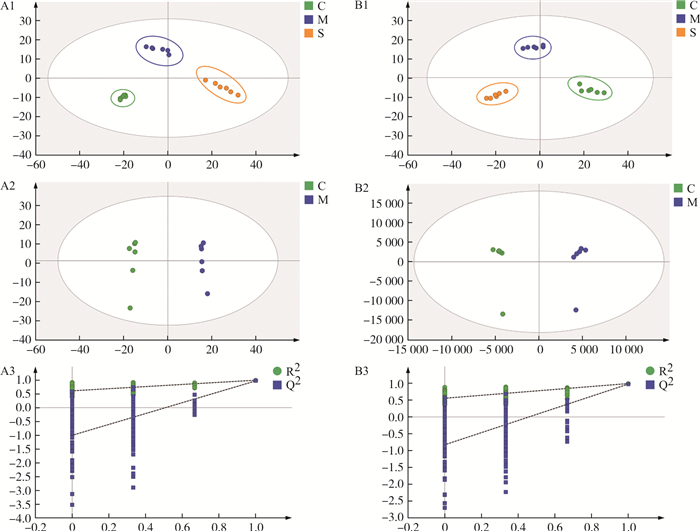
通过PCA和OPLS-DA分析, 绘制样品得分散点图, 结果如图 3所示。在正、负离子模式的PCA分析下, 空白组、模型组和水牛角SHF组之间明显分离, 表明各组血浆样本间代谢图谱存在明显差异。在OPLS-DA评分图中, 空白组和模型组区分明显, 在正离子模式下, R2Y=0.996, Q2=0.971;在负离子模式下, R2Y=0.992, Q2=0.978;200次置换检验结果显示Q2点的回归线在纵坐标的交叉点小于0, 表明模型没有过拟合且对2组之间的差异具有良好的预测。
3.5.2 差异代谢物鉴定
在OPLS-DA分析下, 根据VIP>1且2组间具有显著性差异(P < 0.05)来筛选差异代谢物。根据质谱数据, 在HMDB数据库中共鉴定出137种潜在生物标志物, 具体信息如表 4所示。水牛角SHF给药后可显著回调其中的23个代谢物, 具有显著性差异(P < 0.05)的有16个, 主要包括溶血磷脂酸、磷脂酰肌醇、磷脂酸、甘油三酯、磷脂酰胆碱等。
表 4 潜在差异代谢物Table 4. Potential differential metabolitesNo. tR/min 生物标志物 ESI m/z 含量差异 M vs C S vs M 1 1.78 alpha-CEHC glucuronide + 455.190 8 ↑### ↓*** 2 10.70 PC[DiMe(9, 5)/DiMe(9, 3)] + 839.567 1 ↑### ↓*** 3 10.72 Piritramide + 431.276 6 ↑### ↓*** 4 13.24 TG[18∶1(11Z)/16∶1(9Z)/18∶2(9Z, 12Z)] + 872.769 5 ↑### ↓*** 5 12.42 Trihexosylceramide (d18∶1/16∶0) + 1041.695 1 ↓### ↑*** 6 10.72 Adrenic acid + 355.261 7 ↑## ↓*** 7 11.69 Keratan + 1 070.143 7 ↑### ↓** 8 7.61 1'-O-Acetylpaxilline + 478.266 9 ↑### ↓** 9 13.09 15-Oleoylsolamin + 846.758 0 ↓### ↑* 10 11.66 PA(8∶0/13∶0) + 512.337 7 ↓## ↑* 11 13.24 TG[14∶0/20∶3(5Z, 8Z, 11Z)/20∶2n6] + 898.787 8 ↑### ↓* 12 13.62 TG[14∶0/20∶3(5Z, 8Z, 11Z)/16∶0] + 846.757 7 ↓### ↑* 13 12.89 N-hexadecanoylsphinganine-1-phosphocholine + 705.585 6 ↑## ↓ 14 14.10 TG[16∶0/18∶1(11Z)/18∶3(6Z, 9Z, 12Z)] + 855.747 1 ↑### ↓ 15 12.73 Ligustroside + 525.203 8 ↓### ↑ 16 15.71 PC[18∶0/22∶5(7Z, 10Z, 13Z, 16Z, 19Z)] + 836.625 2 ↓### ↑ 17 9.39 3, 4, 5-Trihydroxy-6-{[(2Z)-2-(phenylmethylidene)Heptyl]oxy}oxane-2-carboxylic acid - 425.187 2 ↑## ↓*** 18 11.88 LysoPA[20∶4(8Z, 11Z, 14Z, 17Z)/0∶0] - 457.238 4 ↓## ↑** 19 15.71 all-trans-Decaprenyl diphosphate - 857.553 6 ↑### ↓** 20 15.28 Isomorellic acid - 605.248 0 ↑# ↓* 21 4.95 Xylometazoline - 289.193 1 ↓## ↑** 22 4.35 Hexobarbital - 281.111 6 ↓### ↑*** 23 4.92 Busulfan - 245.014 9 ↓### ↑*** 24 1.17 3-Dehydroquinate - 189.040 5 ↑### ↓** 25 15.72 PI[18∶1(11Z)/16∶0] - 881.533 5 ↑# ↓** 26 11.89 LysoPA[0∶0/18∶2(9Z, 12Z)] - 433.239 1 ↓# ↑** 27 3.92 Phenol - 93.034 7 ↑### ↓*** 28 11.42 Valerenolic acid - 249.150 7 ↑ ↓ 29 13.09 PE[20∶0/16∶1(9Z)] - 790.551 7 ↓ ↑ 30 1.16 Uric acid - 167.019 6 ↓ ↑ 31 11.47 Sphingosine 1-phosphate - 378.244 8 ↑ ↓ 注: C.空白组; M.模型组; S.水牛角SHF组; 与空白组相比, #P < 0.05, ##P < 0.01, ###P < 0.001;与模型组相比, *P < 0.05, * *P < 0.01, * * *P < 0.001。 3.5.3 代谢通路分析
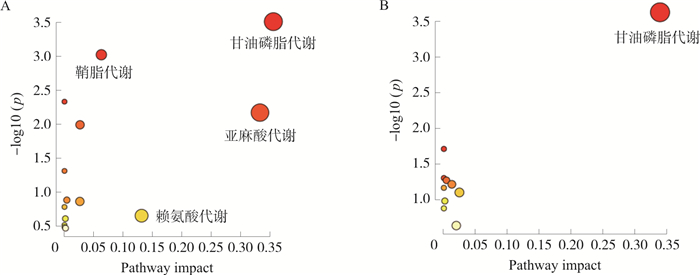
将上述差异代谢物导入MetaboAnalyst 5.0在线分析数据库进行通路富集分析, 如图 4所示, 得到14条与发热相关的代谢通路, 以及水牛角SHF发挥解热作用的10条代谢通路, 以Pathway impact>0.1为标准筛选关键代谢通路[11], 结果表明甘油磷脂代谢通路为水牛角SHF发挥解热作用的主要代谢途径。
4. 讨论
水牛角作为传统的角类动物药, 解热功效确切, 而课题组前期研究及前人报道均表明水牛角发挥解热、抗炎等功效, 与其所含的角蛋白类成分中的-SH及-S-S-有关[1, 12]。因此本文采用SDS-DTT联合提取法制备了水牛角中主要的角蛋白类成分, 通过nano LC-MS/MS技术鉴定得到这些角蛋白类成分主要包括I型角蛋白、Ⅱ型角蛋白、角蛋白相关蛋白和高硫化角蛋白, 并且含-SH肽段主要来源于提取的角蛋白类成分。制备的水牛角SHF的-SH水平较水牛角水提液提高了约20倍, 提示该方法能有效制得水牛角SHF。
本文研究表明, 水牛角SHF对LPS引起的大鼠发热具有显著的抑制作用, 且水牛角SHF低剂量(0.312 5 g·kg-1)在给药1 h后即可表现出显著的解热作用, 显著低于课题组前期研究的水牛角粉或提取物的解热有效剂量(2.75g生药/kg)[13]。然而本文研究的SHF解热作用的剂量依赖性不明显,提示我们进一步降低SHF剂量仍应有解热作用,有待后续进一步研究,以明确水牛角SHF的解热量效关系[14]。本文水提液发挥解热功效的剂量为3.125 g·kg-1, 水牛角SHF的给药剂量仅为水提液的1/10时即可显现出与其相当的解热作用, 这为角类动物药功效物质基础研究提供实验依据, 同时也为类效资源寻找与替代提供一定参考。
引起人体发热的热源包括外源性致热源和内源性致热源, 其中内源性致热源, 如IL-1β、TNF-α等一方面可以通过交感神经使皮肤血管和竖毛肌收缩, 减少散热, 增加产热从而引起发热[15]; 另一方面还可以通过刺激血脑屏障的内皮细胞, 向中枢释放PGE2、cAMP等物质, 间接作用于下丘脑, 引起发热[16-17]。本文研究提示, 水牛角SHF可以显著降低炎性发热大鼠血浆中PGE2、IL-1β、TNF-α以及下丘脑组织中cAMP、PGE2、TNF-α的水平, 从而发挥解热作用。
代谢组学研究表明, 水牛角SHF主要通过回调甘油磷脂类、甘油酯类以及鞘脂类等代谢物发挥解热作用。其中, 甘油磷脂途径的代谢产物, 如磷脂酰胆碱、磷脂酰乙醇胺、磷脂酸、磷脂酰肌醇等可以通过维持细胞膜的稳定性来抵抗外界刺激, 缓解细胞损伤[18]; 富含甘油三酯的脂蛋白生化组成可能是介导炎症的重要因素, 细胞因子如IL-1β、TNF-α的释放取决于甘油三酯、胆固醇和磷脂的百分比[19]; 鞘磷脂是细胞膜重要的结构成分, 有研究表明膳食神经节苷脂可降低LPS诱导后血清中IL-1β和TNF-α的水平[20]。此外, KEGG通路富集分析结果表明水牛角SHF主要通过甘油磷脂代谢途径, 调节脂质代谢, 抑制LPS引起的发热从而发挥清热的传统功效。
综上所述, 本研究通过SDS-DTT联合提取法制备的水牛角SHF, 具有显著的解热、抗炎作用, 进一步验证含-SH类成分为水牛角发挥清热功效的重要物质基础, 且水牛角SHF的解热有效剂量显著低于临床规定用量, 提示我们水牛角SHF在新药创制、珍稀角类动物药类效资源寻找与发现等研究领域具有良好的潜在应用价值。在此基础上, 后续有必要进一步探讨水牛角SHF在体内的作用机制, 为水牛角及其他角类动物药的临床应用与开发提供确切的科学依据。
-
表 1 水牛角水提液和SHF中蛋白和游离-SH含量(x±s, n=3)
Table 1 Protein and free -SH levels in extract of Bubali Cornu(x±s, n=3)
样品 游离巯基浓度/(mmol·L-1) 蛋白浓度/(g·L-1) 游离-SH浓度/蛋白浓度/(mmol·g-1) 水牛角水提液 1.618±0.011 64.505±2.749 0.025±0.001 水牛角SHF 42.188±0.530 86.029±2.417 0.491±0.019 表 2 水牛角SHF的蛋白信息
Table 2 Protein information for SHF in Bubali Cornu
序号 蛋白名称 覆盖率/% 唯一肽段数量 总肽段数量 含-SH肽段数量 1 Keratin-associated protein 3-3 39 2 5 3 2 Keratin-associated protein 3-1 36 2 12 1 3 Keratin, type Ⅰ microfibrillar 48 kDa, component 8C-1 25 8 28 20 4 Keratin, type Ⅱ cuticular Hb1 23 5 18 5 5 Keratin, type Ⅱ cuticular Hb3 20 10 22 15 6 Keratin, high-sulfur matrix protein, ⅢA3 20 4 4 4 7 Keratin, type Ⅰ microfibrillar, 47.6 kDa 19 3 22 13 8 Keratin, type Ⅱ microfibrillar, component 5 18 6 13 4 9 Collagen alpha-1(Ⅰ) chain 17 22 26 - 10 Keratin, type Ⅰ cuticular Ha5 15 4 20 12 11 Ubiquitin-ribosomal protein eL40 fusion protein 15 4 4 - 12 Chymotrypsin-like elastase family member 2A 14 6 6 - 13 Keratin, type Ⅱ cytoskeletal 5 9 19 15 12 14 Collagen alpha-1(Ⅲ) chain 9 15 19 - 15 Collagen alpha-2(Ⅰ) chain 8 9 9 - 16 Heat shock protein beta-1 8 2 2 - 17 Desmocollin-1 4 3 2 1 18 Peroxiredoxin-6 4 2 4 - 19 Desmoglein-1 3 4 4 - 表 3 各组大鼠体温变化(x±s, ℃, n=10)
Table 3 Changes in body temperature of rats in each group(x±s, ℃, n=10)
分组 剂量/(g·kg-1) 基础体温 造模后5.5 h 给药0.5 h 给药1 h 给药1.5 h 空白组 37.36±0.20 36.97±0.20 36.80±0.15 36.82±0.25 36.84±0.15 模型组 37.73±0.30 39.17±0.23### 39.17±0.37### 39.16±0.37### 39.08±0.17### 阿司匹林组 0.10 37.73±0.27 39.05±0.23### 38.53±0.16** 37.78±0.30*** 37.88±0.31*** 水牛角SHF低剂量组 0.312 5 37.72±0.27 39.05±0.31### 38.78±0.19 38.43±0.44*** 38.37±0.51*** 水牛角SHF中剂量组 0.625 37.91±0.13 39.11±0.17### 38.78±0.59* 38.68±0.57** 38.63±0.51** 水牛角SHF高剂量组 1.25 37.85±0.30 39.12±0.25### 38.67±0.36** 38.61±0.35** 38.39±0.41*** 水牛角水提液组 3.125 37.67±0.27 38.90±0.25### 38.71±0.39* 38.61±0.51** 38.32±0.44*** 分组 剂量/(g·kg-1) 给药2 h 给药2.5 h 给药3.5 h 给药4.5 h 空白组 36.87±0.16 36.93±0.18 36.84±0.20 36.99±0.25 模型组 38.85±0.21### 38.71±0.28### 38.61±0.23### 38.47±0.21### 阿司匹林组 0.10 37.83±0.24*** 37.81±0.25*** 37.90±0.27*** 37.75±0.29*** 水牛角SHF低剂量组 0.312 5 38.16±0.49*** 38.14±0.43** 38.13±0.42* 37.94±0.44* 水牛角SHF中剂量组 0.625 38.36±0.47** 38.30±0.30** 38.24±0.37* 37.99±0.31** 水牛角SHF高剂量组 1.25 38.20±0.30*** 38.11±0.31** 37.94±0.28*** 37.87±0.29** 水牛角水提液组 3.125 38.20±0.40*** 38.14±0.51** 38.04±0.31** 37.93±0.27** 注:与空白组相比, ###P < 0.001;与模型组相比, *P < 0.05, * *P < 0.01, * * *P < 0.001。 表 4 潜在差异代谢物
Table 4 Potential differential metabolites
No. tR/min 生物标志物 ESI m/z 含量差异 M vs C S vs M 1 1.78 alpha-CEHC glucuronide + 455.190 8 ↑### ↓*** 2 10.70 PC[DiMe(9, 5)/DiMe(9, 3)] + 839.567 1 ↑### ↓*** 3 10.72 Piritramide + 431.276 6 ↑### ↓*** 4 13.24 TG[18∶1(11Z)/16∶1(9Z)/18∶2(9Z, 12Z)] + 872.769 5 ↑### ↓*** 5 12.42 Trihexosylceramide (d18∶1/16∶0) + 1041.695 1 ↓### ↑*** 6 10.72 Adrenic acid + 355.261 7 ↑## ↓*** 7 11.69 Keratan + 1 070.143 7 ↑### ↓** 8 7.61 1'-O-Acetylpaxilline + 478.266 9 ↑### ↓** 9 13.09 15-Oleoylsolamin + 846.758 0 ↓### ↑* 10 11.66 PA(8∶0/13∶0) + 512.337 7 ↓## ↑* 11 13.24 TG[14∶0/20∶3(5Z, 8Z, 11Z)/20∶2n6] + 898.787 8 ↑### ↓* 12 13.62 TG[14∶0/20∶3(5Z, 8Z, 11Z)/16∶0] + 846.757 7 ↓### ↑* 13 12.89 N-hexadecanoylsphinganine-1-phosphocholine + 705.585 6 ↑## ↓ 14 14.10 TG[16∶0/18∶1(11Z)/18∶3(6Z, 9Z, 12Z)] + 855.747 1 ↑### ↓ 15 12.73 Ligustroside + 525.203 8 ↓### ↑ 16 15.71 PC[18∶0/22∶5(7Z, 10Z, 13Z, 16Z, 19Z)] + 836.625 2 ↓### ↑ 17 9.39 3, 4, 5-Trihydroxy-6-{[(2Z)-2-(phenylmethylidene)Heptyl]oxy}oxane-2-carboxylic acid - 425.187 2 ↑## ↓*** 18 11.88 LysoPA[20∶4(8Z, 11Z, 14Z, 17Z)/0∶0] - 457.238 4 ↓## ↑** 19 15.71 all-trans-Decaprenyl diphosphate - 857.553 6 ↑### ↓** 20 15.28 Isomorellic acid - 605.248 0 ↑# ↓* 21 4.95 Xylometazoline - 289.193 1 ↓## ↑** 22 4.35 Hexobarbital - 281.111 6 ↓### ↑*** 23 4.92 Busulfan - 245.014 9 ↓### ↑*** 24 1.17 3-Dehydroquinate - 189.040 5 ↑### ↓** 25 15.72 PI[18∶1(11Z)/16∶0] - 881.533 5 ↑# ↓** 26 11.89 LysoPA[0∶0/18∶2(9Z, 12Z)] - 433.239 1 ↓# ↑** 27 3.92 Phenol - 93.034 7 ↑### ↓*** 28 11.42 Valerenolic acid - 249.150 7 ↑ ↓ 29 13.09 PE[20∶0/16∶1(9Z)] - 790.551 7 ↓ ↑ 30 1.16 Uric acid - 167.019 6 ↓ ↑ 31 11.47 Sphingosine 1-phosphate - 378.244 8 ↑ ↓ 注: C.空白组; M.模型组; S.水牛角SHF组; 与空白组相比, #P < 0.05, ##P < 0.01, ###P < 0.001;与模型组相比, *P < 0.05, * *P < 0.01, * * *P < 0.001。 -
[1] 陶弘景. 名医别录[M]. 尚志钧, 辑校. 北京: 中国中医药出版社, 2013: 142-143. TAO H J. Miscellaneous records of famous physicians[M]. SHANG Z J, edited and corrected. Beijing: Chinese Medicine Press, 2013: 142-143.
[2] 汤佳瑶, 武文星, 朱悦, 等. 动物药水牛角基础与应用研究进展[J]. 南京中医药大学学报, 2022, 38(10): 880-891. DOI: 10.14148/j.issn.1672-0482.2022.0880 TANG J Y, WU W X, ZHU Y, et al. Research progress on the basis and application of buffalo horn[J]. J Nanjing Univ Tradit Chin Med, 2022, 38(10): 880-891. DOI: 10.14148/j.issn.1672-0482.2022.0880
[3] 刘婷, 韩疏影, 康安, 等. 核壳型Fe3O4@PDA@Au纳米材料对水牛角含巯基肽类成分的富集研究[J]. 南京中医药大学学报, 2020, 36(3): 396-400. http://xb.njucm.edu.cn/article/id/zr20200322 LIU T, HAN S Y, KANG A, et al. Enrichment of thiol-containing peptides in water buffalo horn by core-shell Fe3O4@PDA@Au nano-materials[J]. J Nanjing Univ Tradit Chin Med, 2020, 36(3): 396-400. http://xb.njucm.edu.cn/article/id/zr20200322
[4] ZHU R, SHANG G J, ZHANG B Y, et al. Unlocking the potential of N-acetylcysteine: Improving hepatopancreas inflammation, antioxidant capacity and health in common carp (Cyprinus carpio) via the MAPK/NF-κB/Nrf2 signalling pathway[J]. Fish Shellfish Immunol, 2024, 144: 109294. DOI: 10.1016/j.fsi.2023.109294
[5] KWON D H, CHA H J, LEE H, et al. Protective effect of glutathione against oxidative stress-induced cytotoxicity in RAW 264.7 macrophages through activating the nuclear factor erythroid 2-related factor-2/heme oxygenase-1 pathway[J]. Antioxidants, 2019, 8(4): 82. DOI: 10.3390/antiox8040082
[6] LI G F, FU J H, ZHAO Y, et al. Alpha-lipoic acid exerts anti-inflammatory effects on lipopolysaccharide-stimulated rat mesangial cells via inhibition of nuclear factor kappa B (NF-κB) signaling pathway[J]. Inflammation, 2015, 38(2): 510-519. DOI: 10.1007/s10753-014-9957-3
[7] 庾石山, 王晓良, 符江, 等. 一种角蛋白BD-11、制法和其药物组合物与用途: CN114599672B[P]. 2024-01-23. YU S S, WANG X L, FU J, et al. Keratin BD-11 as well as preparation method, pharmaceutical composition and application thereof: CN114599672B[P]. 2024-01-23.
[8] 杨彪, 胡玉梅, 刘文君, 等. 脂多糖致大鼠发热特点与机制研究进展[J]. 世界科学技术-中医药现代化, 2020, 22(7): 2198-2204. https://www.cnki.com.cn/Article/CJFDTOTAL-SJKX202007011.htm YANG B, HU Y M, LIU W J, et al. Research of progress of the characteristics and mechanism of fever induced by LPS in rats[J]. Mod Tradit Chin Med Mater Med World Sci Technol, 2020, 22(7): 2198-2204. https://www.cnki.com.cn/Article/CJFDTOTAL-SJKX202007011.htm
[9] 赵晶晶, 武文星, 朱昭颖, 等. 牦牛角对LPS诱导发热大鼠模型的解热活性评价及机制研究[J]. 南京中医药大学学报, 2022, 38(10): 936-944. DOI: 10.14148/j.issn.1672-0482.2022.0936 ZHAO J J, WU W X, ZHU Z Y, et al. Evaluation of antipyretic activity and potential mechanism of yak horn on LPS-induced fever rat model[J]. J Nanjing Univ Tradit Chin Med, 2022, 38(10): 936-944. DOI: 10.14148/j.issn.1672-0482.2022.0936
[10] LIU R, HUANG Q, SHAN J J, et al. Metabolomics of the antipyretic effects of bubali Cornu (water buffalo horn) in rats[J]. PLoS ONE, 2016, 11(7): e0158478. DOI: 10.1371/journal.pone.0158478
[11] 武文星, 郭盛, 吴励萍, 等. 免疫应激介导的赤芍缓解补骨脂肝脏毒性作用评价及其调控代谢网络分析[J]. 药学学报, 2021, 56(7): 1789-1796. https://www.cnki.com.cn/Article/CJFDTOTAL-YXXB202107006.htm WU W X, GUO S, WU L P, et al. Paeoniae Rubra Radix decreases the hepatotoxicity of Psoraleae Fructus in an immunologically stressed rat model: A metabolic network analysis[J]. Acta Pharm Sin, 2021, 56(7): 1789-1796. https://www.cnki.com.cn/Article/CJFDTOTAL-YXXB202107006.htm
[12] LIU R, HUANG Q, DUAN J N, et al. Peptidome characterization of the antipyretic fraction of Bubali Cornu aqueous extract by nano liquid chromatography with orbitrap mass spectrometry detection[J]. J Sep Sci, 2017, 40(2): 587-595. DOI: 10.1002/jssc.201600821
[13] LIU R, WANG M, DUAN JA. Antipyretic and antioxidant activities of the aqueous extract of Cornu Bubali (water buffalo horn)[J]. Am J Chin Med, 2010, 38(2): 293-306. DOI: 10.1142/S0192415X10007853
[14] 刘睿, 段金廒, 李友宾, 等. 水牛角主要药效学评价及解热活性物质基础研究[J]. 南京中医药大学学报(自然科学版), 2007, 23(5): 297-301. https://www.cnki.com.cn/Article/CJFDTOTAL-NJZY200705010.htm LIU R, DUAN J A, LI Y B, et al. Pharmacodynamics research of water buffalo horn and the basic study of water baffalo horn antipyretic active compound[J]. J Nanjing Univ Tradit Chin Med, 2007, 23(5): 297-301. https://www.cnki.com.cn/Article/CJFDTOTAL-NJZY200705010.htm
[15] 娄东晓, 严冬, 郭敏, 等. 毛萼香茶菜醇提物对干酵母致热大鼠解热机制研究[J]. 中国药科大学学报, 2019, 50(1): 87-92. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYD201901014.htm LOU D X, YAN D, GUO M, et al. Antipyretic effect of Isodon eriocalyx extracts on yeast-induced fever in rats[J]. J China Pharm Univ, 2019, 50(1): 87-92. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYD201901014.htm
[16] LAI J F, WU H C, QIN A L. Cytokines in febrile diseases[J]. J Interferon Cytokine Res, 2021, 41(1): 1-11.
[17] 吴良发, 周国平, 袁铭铭, 等. 大青叶不同提取物解热作用比较及其机制研究[J]. 中国现代应用药学, 2022, 39(16): 2075-2079. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYD202216005.htm WU L F, ZHOU G P, YUAN M M, et al. Study on comparision of antipyretic effect of different folium isatidis extract and its mechanism[J]. Chin J Mod Appl Pharm, 2022, 39(16): 2075-2079. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYD202216005.htm
[18] ZHAO T T, MA A J, YANG S S, et al. Integrated metabolome and transcriptome analyses revealing the effects of thermal stress on lipid metabolism in juvenile turbot Scophthalmus maximus[J]. J Therm Biol, 2021, 99: 102937.
[19] MORENO-VEDIA J, LLOP D, RODRIGUEZ-CALVO R, et al. Lipidomics of triglyceride-rich lipoproteins derived from hyperlipidemic patients on inflammation[J]. Eur J Clin Invest, 2024, 54(3): e14132.
[20] NORRIS G H, BLESSO C N. Dietary and endogenous sphingolipid metabolism in chronic inflammation[J]. Nutrients, 2017, 9(11): 1180.



 下载:
下载: