Study on the Anti-Liver Fibrosis Mechanism of Atractylenolide Ⅲ Regulating ASCT2-Mediated Mitochondria-Lysosome Interaction to Induce Hepatic Stellate Cell Senescence
-
摘要:
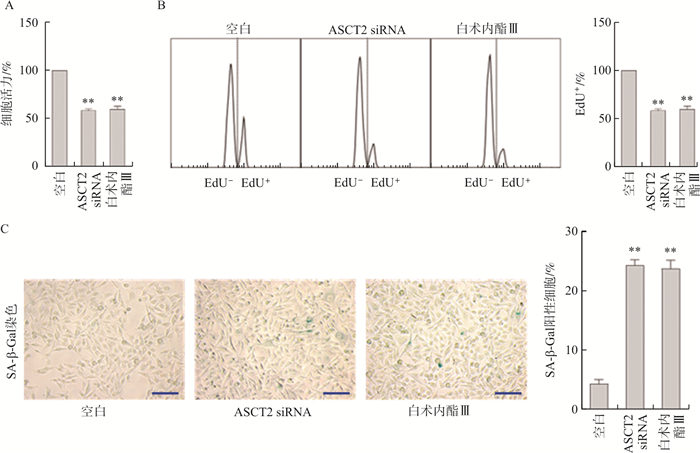
目的 探究白术内酯Ⅲ诱导肝星状细胞(Hepatic stellate cell,HSC)衰老抗肝纤维化作用及机制。 方法 ASCT2 siRNA及白术内酯Ⅲ(40 μmol·L-1)分别作用于人源肝星状细胞LX2以抑制ASCT2, MTT评估细胞活力, EdU法检测细胞增殖, 细胞衰老β-半乳糖苷酶(SA-β-Gal)染色检测细胞衰老; Western blot检测LX2细胞中LC3-Ⅱ/Ⅰ比值的变化, 激光共聚焦检测LC3自噬流和错误蛋白堆积的变化, 同时观察溶酶体标记物LAMP1的荧光情况, 以检测溶酶体功能和数量; 试剂盒检测LX2细胞内ROS、MDA水平及SOD活力, 流式细胞术分析线粒体ROS水平及膜电位。构建CCl4诱导的小鼠肝纤维化模型, 白术内酯Ⅲ 20、30、40 mg·kg-1治疗性给药, HE、Masson和Sirius Red染色观察肝脏组织破坏以及胶原沉积情况, Western blot检测各组小鼠P21、P16表达水平, SA-β-Gal染色以及免疫组化分析衰老细胞的情况和来源。 结果 抑制ASCT2后, LX2细胞活力降低、衰老增加(P<0.01), 同时细胞自噬功能增强、溶酶体数量增多但功能减弱, 加入氯喹(Chloroquine,CQ)清除溶酶体后, 细胞活力和自噬功能增加(P<0.01)。抑制ASCT2后, LX2细胞内MDA、ROS水平上升, SOD活力下降(P<0.01), 其中线粒体ROS水平上升及膜电位下降(P<0.01), 加入鱼藤酮后, 细胞氧化还原稳态和溶酶体数量恢复(P<0.01)。体内实验结果表明, 与模型组比较, 白术内酯Ⅲ改善肝组织结构破坏以及胶原沉积, 诱导肝纤维化小鼠肝组织中的HSC发生衰老, 抑制HSC活化标志物α-平滑肌肌动蛋白(α-SMA)的表达, 促进衰老指标P16、P21的表达(P<0.01)。 结论 白术内酯Ⅲ通过抑制ASCT2诱导线粒体ROS增多、膜电位下降, 进一步促进HSC自噬功能增强、溶酶体数量增多和功能减弱, 从而诱导活化型HSC发生衰老。 Abstract:OBJECTIVE To explore the anti-liver fibrosis effect and mechanism of Atractylenolide Ⅲ-induced hepatic stellate cell (HSC) senescence. METHODS ASCT2 siRNA and Atractylenolide Ⅲ (40 μmol·L-1) acted on human hepatic stellate cells LX2 respectively to inhibit ASCT2, MTT was used to evaluate cell viability, EdU method was used to detect cell proliferation, and senescence associated-β-galactosidase (SA-β-Gal) staining was used to detect cell senescence; Western blot was used to detect changes in the LC3-Ⅱ/Ⅰ ratio in LX2 cells, laser confocal detection was used to detect changes in LC3 autophagy flow and error protein accumulation, and the fluorescence of the lysosomal marker LAMP1 was also observed to detect lysosomal function and quantity; kits were applied to detect ROS and MDA levels as well as SOD activity in LX2 cells, and flow cytometry was used to analyze mitochondrial ROS levels and membrane potential. A CCl4-induced mouse liver fibrosis model was constructed. Atractylenolide Ⅲ was administered at 20, 30, or 40 mg·kg-1. HE, Masson, and Sirius Red staining were used to observe liver tissue damage and collagen deposition. Western blot was used to detect the expression levels of P21 and P16 in mice in each group, and SA-β-Gal staining and immunohistochemistry were used to analyze the situation and origin of senescent cells. RESULTS After inhibiting ASCT2, the viability of LX2 cells decreased and senescence increased (P < 0.01). Meanwhile, the autophagy function was enhanced and the number of lysosomes was increased but the function was weakened. After adding chloroquine (CQ) to clear lysosomes, the cell viability and autophagy function increased(P < 0.01). After inhibiting ASCT2, the levels of MDA and ROS in LX2 cells increased, and the activity of SOD decreased (P < 0.01). Among them, the level of mitochondrial ROS increased and the membrane potential decreased (P < 0.01). After adding rotenone, the cellular redox homeostasis was improved, and the number of lysosomes was restored (P < 0.01). In vivo experimental results showed that compared with the model group, Atractylenolide Ⅲ improved liver tissue structural damage and collagen deposition, induced HSC senescence in liver tissue of mice with liver fibrosis, and inhibited HSC activation marker α-smooth muscle actin (α-SMA), promoted the expression of senescence indicators P16 and P21 (P < 0.01). CONCLUSION Atractylenolide Ⅲ induces an increase in mitochondrial ROS and a decrease in membrane potential by inhibiting ASCT2, which further promotes the enhancement of HSC autophagy function, increases the number of lysosomes and weakens their function, thereby inducing the senescence of activated HSCs. -
Key words:
- atractylenolide Ⅲ /
- ASCT2 /
- hepatic stellate cell /
- senescence /
- liver fibrosis /
- glutamine metabolism
-
图 2 白术内酯Ⅲ抑制ASCT2诱导溶酶体依赖性的HSC衰老
注: 使用ASCT2 siRNA或白术内酯Ⅲ处理LX2细胞,A.Western blot检测LC3-Ⅰ、LC3-Ⅱ的表达情况; B~C.LC3探针检测溶酶体功能; D~E.溶酶体标记物LAMP1荧光质粒检测溶酶体数量; F.错误蛋白堆积ProteoStat染色检测溶酶体功能。使用ASCT2 siRNA或白术内酯Ⅲ及CQ处理LX2细胞,G.Western blot检测LC3-Ⅰ、LC3-Ⅱ的表达情况; H.MTT法评估细胞活力; I~J.溶酶体标记物LAMP1荧光质粒检测溶酶体数量; 与空白组比较, * *P<0.01;与ASCT2组比较, #P<0.05,##P<0.01;与白术内酯Ⅲ组比较, ΔΔP<0.01。标尺=150 μm。
Figure 2. Atractylenolide Ⅲ inhibited ASCT2 to induce lysosome-dependent HSC senescence
图 3 白术内酯Ⅲ通过抑制ASCT2介导的线粒体-溶酶体互作诱导HSC的衰老
注: 使用ASCT2 siRNA或白术内酯Ⅲ处理LX2细胞,A.HSC细胞中MDA、SOD、ROS水平; B.流式细胞术检测及定量分析线粒体ROS; C.流式细胞术测JC-1探针检孵育后的线粒体膜电位。使用ASCT2 siRNA或白术内酯Ⅲ及Rotenone处理LX2细胞,D.HSC细胞中MDA、SOD、ROS水平; E~F.溶酶体标记物LAMP1荧光质粒检测溶酶体数量; G~H.溶酶体探针检测溶酶体数量。与空白组比较, * * P<0.01;与ASCT2组比较, ## P<0.01;与白术内酯Ⅲ组比较, ΔΔ P<0.01。标尺=150 μm。
Figure 3. Atractylenolide Ⅲ induced HSC senescence through inhibition of ASCT2-mediated mitochondrial-lysosomal interaction
图 4 白术内酯Ⅲ通过诱导HSC衰老抗肝纤维化
注: A.HE、Masson和Sirius Red染色, 标尺=50 μm; B.Western blot分析衰老指标P16和P21蛋白表达;C.SA-β-Gal衰老染色以及α-SMA免疫组化染色的代表图像和量化, 标尺=25 μm, 箭头表示SA-B-Gal染色阳性的细胞。与空白组比较, * * *P<0.01;与CCl4组比较, ##P<0.01, ###P<0.001。标尺=50 μm。
Figure 4. Atractylenolide Ⅲ inhibited liver fibrosis by inducing HSC senescence
-
[1] FORBES S J, GUPTA S, DHAWAN A. Cell therapy for liver disease: From liver transplantation to cell factory[J]. J Hepatol, 2015, 62(Suppl 1): S157-S169. [2] GANGULY N, CHAKRABARTI S. Role of long non-coding RNAs and related epigenetic mechanisms in liver fibrosis[J]. Int J Mol Med, 2021, 47(3): 04856. [3] 李浩, 吴勉华, 马艳霞, 等. 中药调控铁死亡抑制肝纤维化的研究进展[J]. 南京中医药大学学报, 2023, 39(6): 587-593. doi: 10.14148/j.issn.1672-0482.2023.0587LI H, WU M H, MA Y X, et al. Research progress of traditional Chinese medicine regulating ferroptosis to inhibit hepatic fibrosis[J]. J Nanjing Univ Tradit Chin Med, 2023, 39(6): 587-593. doi: 10.14148/j.issn.1672-0482.2023.0587 [4] IREDALE J P. Models of liver fibrosis: Exploring the dynamic nature of inflammation and repair in a solid organ[J]. J Clin Invest, 2007, 117(3): 539-548. doi: 10.1172/JCI30542 [5] KIM J Y, LEE S H, BAE I H, et al. Pyruvate protects against cellular senescence through the control of mitochondrial and lysosomal function in dermal fibroblasts[J]. J Invest Dermatol, 2018, 138(12): 2522-2530. doi: 10.1016/j.jid.2018.05.033 [6] ZHANG M F, SERNA-SALAS S, DAMBA T, et al. Hepatic stellate cell senescence in liver fibrosis: Characteristics, mechanisms and perspectives[J]. Mech Ageing Dev, 2021, 199: 111572. doi: 10.1016/j.mad.2021.111572 [7] SUN Y, WENG J D, CHEN X L, et al. Oroxylin A activates ferritinophagy to induce hepatic stellate cell senescence against hepatic fibrosis by regulating cGAS-STING pathway[J]. Biomed Pharmacother, 2023, 162: 114653. doi: 10.1016/j.biopha.2023.114653 [8] CHEN L G, CHEN X W, HUANG X, et al. Regulation of glucose and lipid metabolism in health and disease[J]. Sci China Life Sci, 2019, 62(11): 1420-1458. doi: 10.1007/s11427-019-1563-3 [9] TRIVEDI P, WANG S, FRIEDMAN S L. The power of plasticity-metabolic regulation of hepatic stellate cells[J]. Cell Metab, 2021, 33(2): 242-257. doi: 10.1016/j.cmet.2020.10.026 [10] YIN X C, PENG J, GU L H, et al. Targeting glutamine metabolism in hepatic stellate cells alleviates liver fibrosis[J]. Cell Death Dis, 2022, 13(11): 955. doi: 10.1038/s41419-022-05409-0 [11] WU H Y, WU L X, XIAO L X, et al. Atractylenolide Ⅲ suppresses senescence-associated secretome via inhibiting cGAS/NF-κB pathway in hepatic stellate cells[J]. Clin Exp Pharmacol Physiol, 2023, 50(4): 316-324. doi: 10.1111/1440-1681.13753 [12] XIE Z Y, LIN M Q, HE X, et al. Chemical constitution, pharmacological effects and the underlying mechanism of atractylenolides: A review[J]. Molecules, 2023, 28(10): 3987. doi: 10.3390/molecules28103987 [13] GUO Y Y, XIAO Y Y, ZHU H Y, et al. Inhibition of proliferation-linked signaling cascades with atractylenolide I reduces myofibroblastic phenotype and renal fibrosis[J]. Biochem Pharmacol, 2021, 183: 114344. doi: 10.1016/j.bcp.2020.114344 [14] HUAI B, DING J Y. Atractylenolide Ⅲ attenuates bleomycin-induced experimental pulmonary fibrosis and oxidative stress in rat model via Nrf2/NQO1/HO-1 pathway activation[J]. Immunopharmacol Immunotoxicol, 2020, 42(5): 436-444. doi: 10.1080/08923973.2020.1806871 [15] WANG F X, LI Z H, CHEN L, et al. Inhibition of ASCT2 induces hepatic stellate cell senescence with modified proinflammatory secretome through an IL-1 α/NF-κB feedback pathway to inhibit liver fibrosis[J]. Acta Pharm Sin B, 2022, 12(9): 3618-3638. doi: 10.1016/j.apsb.2022.03.014 [16] KRIZHANOVSKY V, YON M, DICKINS R A, et al. Senescence of activated stellate cells limits liver fibrosis[J]. Cell, 2008, 134(4): 657-667. doi: 10.1016/j.cell.2008.06.049 [17] PERVEEN R, OZAKI I, MANIRUJJAMAN M, et al. Induction of premature senescence and a less-fibrogenic phenotype by programmed cell death 4 knockdown in the human hepatic stellate cell line Lieming Xu-2[J]. Hum Cell, 2023, 36(2): 583-601. [18] PARK J T, LEE Y S, CHO K A, et al. Adjustment of the lysosomal-mitochondrial axis for control of cellular senescence[J]. Ageing Res Rev, 2018, 47: 176-182. doi: 10.1016/j.arr.2018.08.003 [19] ROVIRA M, SEREDA R, PLADEVALL-MORERA D, et al. The lysosomal proteome of senescent cells contributes to the senescence secretome[J]. Aging Cell, 2022, 21(10): e13707. doi: 10.1111/acel.13707 -




 下载:
下载: