Study on Clinical Efficacy and Mechanism of Jianpi Yangwei Formula Combined with Neoadjuvant Chemotherapy for Patients with Gastric Cancer
-
摘要: 目的 观察健脾养胃方配合新辅助化疗对胃癌患者临床疗效的影响及机制研究。方法 按照随机数字表法将56例胃癌患者随机分为对照组(29例)和治疗组(27例)。对照组给予以奥沙利铂和替吉奥为主的SOX术前新辅助化疗方案,治疗组在新辅助化疗基础上配合健脾养胃方治疗。观察2组患者术前辅助化疗疗效(TRG分级)、中医证候积分的变化;免疫组化检测胃癌组织中叉头状转录因子P3(FoxP3)、T细胞免疫球蛋白黏蛋白分子3(Tim3)蛋白的表达;实时定量PCR检测胃癌组织白细胞介素-10(IL-10)、白细胞介素-2(IL-2)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)mRNA的水平。结果 治疗后,与对照组相比,治疗组TRG分级评分降低(P < 0.05);治疗组中医证候积分显著低于治疗前(P < 0.05~0.01),且低于对照组(P < 0.05);与对照组相比,治疗组胃癌组织Tim3、FoxP3蛋白水平降低(P < 0.05),IL-8、IL-10 mRNA水平降低(P < 0.05)。结论 健脾养胃方配合新辅助化疗方案,可有效提高胃癌新辅助化疗的临床疗效,机制可能与该方调节患者肿瘤微环境中Tim3、FoxP3及IL-8、IL-10有关。Abstract: OBJECTIVE To observe the clinical efficacy and mechanism of Jianpi Yangwei Formula combined with neoadjuvant chemotherapy (NACT) on patients with gastric cancer.METHODS According to the random number table method, 56 patients with gastric cancer were randomly divided into the control group (29 cases) and the treatment group (27 cases). The control group was given preoperative NACT consisting of oxaliplatin and tegafur-gimeracil-oteracil potassium capsule, and the treatment group was treated with Jianpi Yangwei formula besides NACT. The tumor regression grade (TRG) and TCM syndrome scores were observed in the two groups. The expressions of forkhead box protein 3 (FoxP3) and T cell immunoglobulin domain and mucin domain 3 (Tim3) protein in gastric cancer tissues were detected with immunohistochemistry. Real-time PCR was applied to detect the levels of interleukin-10 (IL-10), interleukin-2 (IL-2), interleukin-8 (IL-8), and tumor necrosis factor-α (TNF-α).RESULTS After treatment, the TRG score of the treatment group was lower than that of the control group (P < 0.05). The TCM syndrome score in the treatment group was decreased significantly after treatment (P < 0.05, P < 0.01), and less than that in the control group (P < 0.05). Compared with the control group, the protein expressions of Tim3 and FoxP3 in gastric cancer tissue of the treatment group decreased (P < 0.05), and the levels of IL-8 and IL-10 also decreased (P < 0.05).CONCLUSION Jianpi Yangwei formula combined with neoadjuvant chemotherapy can effectively improve the clinical efficacy of NACT for gastric cancer. The mechanism may be related to the regulation of Tim3, FoxP3 and IL-8, IL-10 in the tumor microenvironment.
-
Key words:
- Jianpi Yangwei formula /
- gastric cancer /
- tumor immunity /
- Tim3 /
- Treg
-
表 1 2组患者一般临床资料比较(x±s)
组别 性别 年龄/岁 TNM分期 男 女 Ⅰ Ⅱ Ⅲa Ⅲb Ⅲc 对照组 24 5 60.69±10.44 2 12 6 7 2 治疗组 21 6 58.93±9.91 1 8 4 7 7 表 2 肿瘤术前辅助治疗疗效评估
肿瘤退缩分级(TRG) 光镜下所见 0(完全退缩) 无肿瘤细胞残留(包括淋巴结) 1(中等退缩) 仅见单个或小灶癌细胞残留 2(轻微退缩) 肿瘤残留但少于纤维化间质 3(无退缩) 广泛肿瘤残留,无或少量肿瘤细胞坏死 注: a.评分仅限于原发肿瘤病灶;b.肿瘤细胞指存活的瘤细胞,不包括退变坏死细胞;c.化疗后可能出现的无细胞黏液湖,不能将其认为肿瘤残余。 表 3 目的基因的引物序列
名称 上游引物(5'→3') 下游引物(5'→3') TNF-α CCCAGGGACCTCTCTCTAATC TGAGGTACAGGCCCTCTGAT IL-2 ACCTCAACTCCTGCCACAAT TCCTGGTGAGTTTGGGATTC IL-10 CCACGCTTTCTAGCTGTTGA CTCCGAGACACTGGAAGGTG IL-8 TGCAGCTCTGTGTGAAGGTG ACTTCTCCACAACCCTCTGC β-actin TCACCCACACTGTGCCCATCTACGA CAGCGGAACCGCTCATTGCCAATGG 表 4 2组患者TRG分级比较
组别 例数 0级 1级 2级 3级 对照组 29 0 2 6 21 治疗组 27 0 2 14 11 注: 组间比较,X2=6.398,P < 0.05。 表 5 2组患者治疗前后中医证候积分比较(x±s)
组别 时间 例数 胃痛 腹胀 乏力 纳差 对照组 治疗前 29 3.62±0.46 2.55±0.31 4.35±0.53 4.14±0.38 第21天 29 2.07±0.34 2.07±0.35 4.55±0.51 3.41±0.32 第42天 29 1.66±0.28** 1.72±0.30 3.10±0.38 3.00±0.40 治疗组 治疗前 27 3.56±0.51 2.74±0.34 4.33±0.37 4.89±0.43 第21天 27 2.67±0.46 2.00±0.24 3.44±0.45 3.22±0.42* 第42天 27 1.77±0.33* 0.96±0.20 1.22±0.29**# 1.22±0.29*# 组别 时间 例数 气短 恶心呕吐 便溏 消瘦 对照组 治疗前 29 1.24±0.28 1.93±0.23 3.00±0.39 3.38±0.27 第21天 29 1.03±0.27 1.79±0.25 3.00±0.47 2.83±0.23 第42天 29 0.83±0.25 1.93±0.23 2.69±0.43 2.48±0.19 治疗组 治疗前 27 1.56±0.34 2.07±0.33 2.67±0.33 3.71±0.32 第21天 27 1.00±0.28 2.00±0.30 2.44±0.45 2.67±0.24 第42天 27 1.11±0.32 1.85±0.21 1.89±0.40 1.41±0.26*# 注:与治疗前比较,*P < 0.05,**P < 0.01;组间比较,#P < 0.05。 表 6 2组患者治疗前后中医证候总积分比较(x±s)
组别 例数 治疗前 第21天 第42天 对照组 29 24.21±1.40 20.86±1.14 17.31±1.04 治疗组 27 25.51±1.25 19.78±1.40 11.44±1.23**# 注:与治疗前比较,**P < 0.01;组间比较,#P < 0.05。 表 7 2组患者中医证候总体疗效判定
组别 时间 例数 痊愈 显效 有效 无效 总有效率/% 对照组 第21天 29 0 1 3 25 13.79 第42天 29 0 1 10 18 37.93 治疗组 第21天 27 0 1 4 22 18.52 第42天 27 0 6 12 9 66.66# 注:组间比较,X42天2=6.69,#P < 0.05。 表 8 2组患者瘤体组织中Tim3、FoxP3蛋白表达情况比较(x±s)
组别 例数 Tim3 FoxP3 对照组 29 14.15±1.07 13.64±1.18 治疗组 27 11.46±0.67# 10.77±0.73# 注:组间比较,#P < 0.05。 表 9 2组患者肿瘤组织中炎症因子mRNA表达情况比较(x±s)
组别 例数 IL-2 IL-8 IL-10 TNF-α 对照组 29 1.07±0.12 1.03±0.07 1.02±0.07 1.11±0.15 治疗组 27 1.42±0.36 0.82±0.07# 0.83±0.05# 1.77±0.32 注:组间比较,#P < 0.05。 -
[1] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. doi: 10.3322/caac.21338 [2] ALLEMANI C, MATSUDA T, DI CV, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet Gastroenterol Hepatol, 2018, 391(10125): 1023-1075. http://www.sciencedirect.com/science/article/pii/S0140673617333263 [3] LI WL, NG JM, WANG CC, et al. Molecular alterations of cancer cell and tumour microenvironment in metastatic gastric cancer[J]. Oncogene, 2018: 4903-4920. http://www.researchgate.net/publication/325318070_Molecular_alterations_of_cancer_cell_and_tumour_microenvironment_in_metastatic_gastric_cancer/fulltext/5b056dd64585157f87091615/325318070_Molecular_alterations_of_cancer_cell_and_tumour_microenvironment_in_metastatic_gastric_cancer.pdf?origin=publication_detail [4] KLEMM F, JOYCE JA. Microenvironmental regulation of therapeutic response in cancer[J]. Trends Cell Biol, 2015, 25(4): 198-203. doi: 10.1016/j.tcb.2014.11.006 [5] ANTONI R, JEDD DW. Cancer immunotherapy using checkpoint blockade[J]. Science, 2018, 359(6382): 1350-1355. doi: 10.1126/science.aar4060 [6] MONNEY L, SABATOS CA, GAGLIA JL, et al. Th1-specific cell surface protein Tim-3 regulates macrophage activation and severity of an autoimmune disease[J]. Nature, 2002, 415(6871): 536-545. doi: 10.1038/415536a [7] ANA CA, NICOLE J, VIJAY KK. Lag-3, Tim-3, and Tigit: co-inhibitory receptors with specialized functions in immune regulation[J]. Immunity, 2016, 44(5): 989-1004. doi: 10.1016/j.immuni.2016.05.001 [8] WU JL, LIN GW, ZHU Y, et al. Low Tim3 expression indicates poor prognosis of metastatic prostate cancer and acts as an independent predictor of castration resistant status[J]. Sci Rep, 2017, 7(1): 8869-8893. doi: 10.1038/s41598-017-09484-8 [9] 李小江, 邬明歆, 孔凡铭, 等. 中药有效成分抗肿瘤活性及作用机制研究进展[J]. 中草药, 2020, 51(9): 2587-2592. https://www.cnki.com.cn/Article/CJFDTOTAL-ZCYO202009036.htm [10] 舒鹏, 武雯. 健脾养胃方联合化疗对胃癌Ⅱ、Ⅲ期术后干预作用的临床研究[J]. 实用临床医药杂志, 2013, 17(3): 16-18. https://www.cnki.com.cn/Article/CJFDTOTAL-XYZL201303006.htm [11] 王敏, 刘沈林, 吴坚, 等. 健脾养胃方联合5-FU对MFC荷瘤小鼠皮下移植瘤的生长及免疫功能的影响. [J]. 中国实验方剂学杂志, 2019, 25(6): 65-72. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX201906010.htm [12] AMIN MB, EDGE S, GREENE F, et al. AJCC cancer staging manual[M]. New York: Springer, 2016: 203-220. [13] 中华人民共和国卫生部医政司. 胃癌诊疗规范(2011年版)[J]. 中国医学前沿杂志(电子版), 2012, 4(5): 62-71. doi: 10.3969/j.issn.1674-7372.2012.05.015 [14] 中药新药临床研究指导原则(试行)[M]. 北京: 中国医药科技出版社, 2002: 221-222. [15] 朱文峰. 中医诊断学[M]. 北京: 中国中医药出版社, 2002: 185-188, 196-198. [16] 刘沈林. 中医药治疗胃癌临床述评[J]. 江苏中医药, 2019, 51(4): 1-5. doi: 10.3969/j.issn.1672-397X.2019.04.001 [17] 刘沈林. 论虚虚之戒与肿瘤的扶正之法[J]. 江苏中医药, 2018, 50(3): 1-4. doi: 10.3969/j.issn.1672-397X.2018.03.003 [18] TANAKA A, SAKAGUCHI S. Regulatory T cells in cancer immunotherapy[J]. Cell Res, 2017, 27(1): 109-118. doi: 10.1038/cr.2016.151 [19] DAS M, ZHU C, KUCHROO V. Tim-3 and its role in regulating anti-tumor immunity[J]. Immunological Rev, 2017, 276(1): 97-111. doi: 10.1111/imr.12520 [20] BU MM, SHEN YZ, WILLIAM L, et al. Ovarian carcinoma-infiltrating regulatory T cells were more potent suppressors of CD8+ T cell inflammation than their peripheral counterparts, a function dependent on Tim3 expression[J]. Tumor Biol, 2016, 37(3): 3949-3956. doi: 10.1007/s13277-015-4237-x [21] SHEN PY, YUE RX, TANG JH, et al. Preferential Tim-3 expression on Treg and CD8+ T cells, supported by tumor-associated macrophages, is associated with worse prognosis in gastric cancer[J]. Am J Translres, 2016, 8(8): 3419-3428. http://europepmc.org/abstract/PMC/PMC5009394 [22] YU JT, ZHANG HH, SUN SB, et al. The effects of Tim3 activation on Tcells in gastric cancer progression[J]. Oncol Lett, 2019, 17(2): 1461-1466. [23] 李园, 刘慧, 张彦博, 等. 健脾扶正方对大肠癌术后化疗患者T细胞亚群、Treg细胞及生活质量的影响[J]. 中医药导报, 2019, 25(6): 49-52, 59. https://www.cnki.com.cn/Article/CJFDTOTAL-HNZB201906014.htm [24] 刘玉. 基于Tim3调控Th1细胞探讨益气脱敏汤治疗变应性鼻炎的机制研究[D]. 南京: 南京中医药大学, 2016. [25] 杨玉琪, 王红梅, 宋娜丽, 等. 中药治疗对HIV感染者T细胞表面PD-1和Tim-3表达水平干预的研究[J]. 云南中医中药杂志, 2016, 37(9): 76-78. https://www.cnki.com.cn/Article/CJFDTOTAL-YZYY201609035.htm [26] 于益芝, 曹雪涛. 调节性T细胞在肿瘤免疫和肿瘤免疫治疗中的作用[J]. 中国肿瘤生物治疗杂志, 2010, 17(1): 1-6. doi: 10.3872/j.issn.1007-385X.2010.01.001 [27] 杨青, 张香梅, 翁晨刚, 等. IL-8在肿瘤中的作用及机制研究进展[J]. 山东医药, 2019, 59(4): 96-98. https://www.cnki.com.cn/Article/CJFDTOTAL-SDYY201904027.htm [28] 肖乾坤, 王晓倩, 陈奎生, 等. 白介素-8与肿瘤关系的研究进展[J]. 肿瘤基础与临床, 2020, 33(1): 89-92. https://www.cnki.com.cn/Article/CJFDTOTAL-HLZL202001026.htm [29] WU WM, SUEN JL, CHIANG BL. Tamoxifen alleviates disease severity and decreases double negative T cells in autoimmune MRL-lpr/lpr mice[J]. Immunology, 2000, 100(1): 110-118. doi: 10.1046/j.1365-2567.2000.00998.x [30] 洪文文. 香砂六君子汤对进展期胃癌化疗患者免疫功能的影响[D]. 南京: 南京中医药大学, 2018. [31] 张云璧, 瞿幸, 牛福玲. 常用治疗银屑病的中药对肿瘤坏死因子-α刺激后角质形成细胞生长及分泌白介素-8的影响[J]. 中国中西医结合皮肤性病学杂志, 2006, 5(1): 18-20. https://www.cnki.com.cn/Article/CJFDTOTAL-ZXYD200601005.htm -
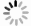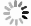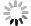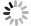




 下载:
下载: